

Vol. 39 (Nº 42) Año 2018 • Pág. 23
Lita SORROZA Ochoa 1; Ana PINTO Molina 2; Roberto SANTACRUZ Reyes 3; Galo SOLANO Motoche 4; Edison ECHEVERRÍA Espinoza 5; Mauricio YÁNEZ Morocho 6
Recibido: 25/04/2018 • Aprobado: 11/06/2018
RESUMEN: La harina y el aceite de pescado son fundamentales en la actividad acuícola por su valor nutricional. Una mala calidad de estos es responsable del daño celular en los organismos acuáticos. Por eso, es necesario conocer la calidad del aceite en la fabricación de balanceados. Este trabajo tiene como finalidad comparar el perfil de ácidos grasos presentes en el aceite de pescado, que se utilizan en el cultivo de Litopenaeus vannamei. Los resultados señalan que el aceite de pescado, presentan buena calidad. |
ABSTRACT: Fish meal and fish oil are cornerstones in aquaculture due to their nutritional value. The poor quality both are responsible for cell damage in aquatic organisms. For this reason, it is necessary to know certain quality parameters of the raw materials before being used in the feedstuffs manufacturing. The purpose of this work is to compare the fatty acid profile present in fish oil, which are used for the culture of Litopenaeus vannamei. The results indicated that fish oil samples, have a good quality |
La acuicultura es el sector de origen animal que actualmente presenta un rápido crecimiento a nivel mundial, y para mantenerse a ese nivel de producción es necesario contar con alimentos de buena calidad que contribuyan al desarrollo de los organismos acuáticos cultivables.
El aceite de pescado, junto con la harina es la fuente primaria más utilizada por la industria acuícola, lo cual ha creado una gran demanda de este insumo (Stickney 2005, Tacon & Metian 2008), así tenemos que el rol del aceite de pescado es preponderante y limitante en la acuacultura debido a que cerca del 85% de lo que se produce a nivel mundial se emplea en el sector acuícola, en donde sólo para el cultivos de salmón es necesario el 55% de la demanda total de esta materia prima (FAO 2008).
Los aminoácidos junto con los lípidos son esenciales en la dieta de animales acuáticos por lo que su aporte es fundamental para una serie de procesos metabólicos (NRC 1993). Actualmente, la mayoría del aceite de pescado de origen marino se destina a la elaboración de alimentos balanceados para acuacultura, asegurando así el adecuado desarrollo de peces y crustáceos e impartiendo valiosas propiedades al producto final, y por ende esto hace que se promueva la salud del consumidor (Halver & Hardy 2002, Kris-Etherton et al., 2003).
El aceite de pescado es rico en ácidos grasos del grupo de los omega-3 de cadena larga, particularmente el eicosapentaenoico (EPA) y el docosahexaenoico (DHA), así como vitaminas liposubles (A y D), algunos son buenas fuentes de astaxantina (Zaldívar-Larran 2002), y son hoy en día biomoléculas de naturaleza lipídica altamente valoradas por sus propiedades profilácticas y terapéuticas, además, son utilizados no solo a nivel nutricional sino también para el control de enfermedades tanto en humanos como en animales terrestres y acuáticos, hecho ampliamente documentado por la comunidad científica y médica (Hasler 2002, Hardman 2004, Valenzuela 2012).
La habilidad de los peces marinos y crustáceos de bio-sintetizar fosfolípidos a partir de ácidos grasos y diglicéridos es un hecho (Kanazawa et al., 1979b), pero aún no está confirmado si existe un verdadero requerimiento de fosfolípidos para la dieta en camarones (Kayama et al., 1980, D’Abramo et al., 1997). No obstante, su efecto benéfico en las larvas al ser incluidos en las dietas, ha sido ampliamente demostrado.
Esto puede ser debido a un requerimiento específico de algunos fosfolípidos para el transporte de lípidos en la hemolinfa, particularmente el colesterol y a una baja tasa de biosíntesis de fosfolípidos en relación a su demanda metabólica durante el desarrollo larval (Clark & Lawrence 1988, Cahu et al., 1995, Camara et al., 1997), esta capacidad limitada para la biosíntesis de fosfolípidos también fue encontrada en hembras maduras de Litopenaeus vannamei (Middledich et al., 1979, Lubzens et al., 1995, González-Félix & Pérez-Velásquez 2002), lo que indica que son necesarios para estos organismos acuáticos en todas sus fases del crecimiento.
El aceite de pescado posee un alto contenido de ácidos grasos poliinsaturados (AGPI) n-3, muy susceptibles a los procesos de autooxidación (Aidos et al., 2003a, Lewis-McCrea & Lall 2007). Se sabe que la ingesta de lípidos oxidados va a influir sobre parámetros productivos, salud animal y respuesta fisiológica en camarones y peces. Así tenemos, que la alimentación con aceites oxidados tuvo un efecto negativo en la producción de Penaeus monodon, Sparus aurata, Salmo salar, Clarias gariepinus, Oreochromis spp., pues genera una disminución en las tasas de crecimiento, consumo y en el factor de conversión alimenticia (Koshio et al., 1994, Baker & Davies 1996, Mourente et al., 2002, Herrera & Zambrano 2005, Laohabanjong et al., 2009).
Entre otras señales patológicas reportadas en peces por la ingesta de lípidos en mal estado, se encuentra la pérdida del apetito, distrofia muscular, alta mortalidad por la degeneración hepática, anemia, reducción de los niveles de vitamina E y C, disminución de la capacidad visual, anormalidades cerebrales, deformidades a nivel de retina y en la cabeza anormalidades tipo escoliosis y lordosis, además desestabilización de las membranas lipídicas celulares (Tacon 1992, Stephan et al., 1995, Estévez et al., 1997, Daskalov et al., 2000).
Desde el punto de vista de la seguridad alimentaria es necesario que el consumidor, en este caso, el sector productivo acuícola, conozca la calidad del producto que está utilizando, ya que los mismos pueden verse adulterados en sus características debido al mal manejo que se le pueda dar, es decir, un almacenamiento inadecuado o por la forma de procesar la materia prima.
De ahí la importancia que en esta investigación se haga un estudio de la calidad de los aceites comerciales de pescado que generalmente son utilizados por el sector camaronero, ya sea como aditivo para mejorar la palatabilidad del alimento balanceado a la hora de usar antibióticos u otros compuestos químicos, o como suplemento alimenticio para aumentar la disponibilidad de energía que se provee a los animales de cultivo.
Tres muestras de aceite de pescado fueron obtenidas en los Sectores de Manta, y la Península de Santa Elena, provincias ubicadas al norte del Ecuador, en las costas del Océano Pacífico, lugares en donde se produce aceite de pescado para comercializar. En el presente estudio se compararon los análisis de laboratorio de las diferentes muestras de pescado con un aceite de pescado sin procesar y otro refinado, el cual sirvió como referencia de calidad.
Para la comparación de los tres aceites de pescado se hicieron los análisis siguiendo las normas ISO de calidad. Las muestras fueron analizadas por duplicado, y fueron procesadas en el laboratorio WSS Ecuador S.A, ubicado en la ciudad de Guayaquil, mismo que está acreditado para este tipo de análisis. Para el análisis estadístico se utilizó ANDEVA de una vía. Cualquier diferencia estadística significativa luego de análisis se separó mediante una prueba de Duncan. Datos expresados en porcentajes fueron convertidos a ARCSIN previo al análisis estadístico.
Los métodos analíticos que se utilizaron según norma ISO se mencionan a continuación:
Perfil de ácidos grasos.- se realizó por el método de Cromatografía liquida (UPLC- PDA POE- LI- 018).
Índice de peróxidos.- por el método de Volumetría P-LQ- 13 (NTE INEN 37 0277: 1978- 02)
Índice de yodo.- método de WijS (NTE INEN 37)
Grasa: P- LQ- 08 (NTP 204 033: 1985)
Humedad.- por el método de estufa P-LQ-09 (ISO 6496:1999).
Adicionalmente, además del análisis de las muestras, se realizaron encuestas a productores de camarón en diferentes sectores de la Provincia de El Oro para saber el uso, consumo y la aplicación que le dan al aceite de pescado.
En la Tabla 1 se muestran los parámetros físicos que determinan la calidad del aceite de pescado.
Tabla 1
Análisis comparativo de parámetros de calidad de aceite de
pescado (promedio ± D.E.) expresado en porcentaje (%)

Nota: significancia estadística al 5%. Superíndices diferentes expresan diferencia estadística entre muestras.
Se puede observar que la muestra 3 (M3) tuvo un mayor grado de impurezas al compararse con la M1 (95,9%) y M2 (290,1%), mientras que cuando se las compara con los aceites referenciales, todas las muestras analizadas mostraron muy bajas concentraciones de impurezas (< 0,05). Comparando el porcentaje de lípidos de las muestras, se observa que tanto las muestras como los aceites referenciales tienen concentraciones similares de estos, no habiendo diferencia estadística alguna en la comparación. Por otro lado, la muestra M2 tuvo un índice de yodo mayor que la M3, teniendo la M1 un índice de yodo intermedio entre la M2 y M3, sin embargo no hubo diferencia estadística significativa (> 0,05) entre las muestras. En cuanto al índice de peróxido, el análisis estadístico indicó que las tres muestras de aceite fueron diferentes (< 0,05) en éste parámetro, siendo la muestra M2 la que presentó el mayor índice de peróxido, seguida por la M1 y finalmente la M3. De una manera similar, al analizar la humedad, se encontró que la muestra 3 (M3) reportó mayor éste parámetro, seguida por la M1 y M2, habiendo diferencia estadística significativa entre las tres muestras.
Por otro lado, en la Tabla 2 se pueden observar los resultados obtenidos del perfil de ácidos grasos de las tres muestras analizadas.
Tabla 2
Perfil de ácidos grasos (promedio ± D.E.) de aceites
comerciales de pescado expresado en porcentaje (%)
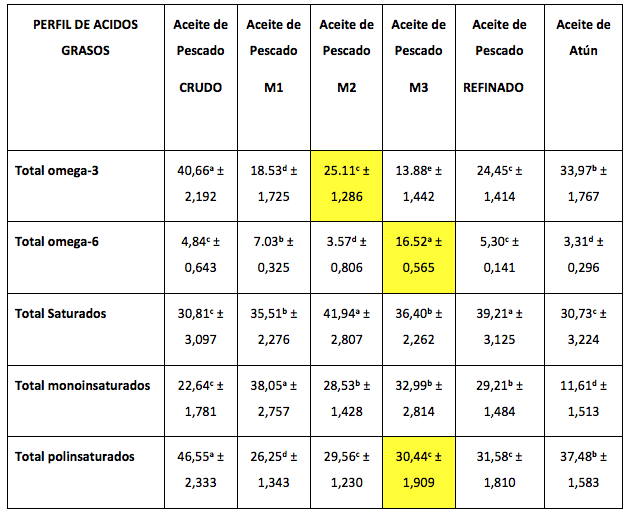
Nota: significancia estadística al 5%. Superíndices diferentes expresan diferencia estadística entre muestras.
En cuanto a los ácidos grasos omega-3 la muestra M2 fue mayor que la M1 (35,5%) y que la M3 (80,9%), siendo así mismo estadísticamente diferentes (< 0,05) al compararse entre ellas. Sin embargo, cuando las tres muestras se compararon con los aceites referenciales, se observa que todas ellas presentaron en términos generales menor concentración de estos ácidos grasos. Al comparar la concentración de ácidos grasos omega-6, la muestra M3 fue mucho mayor que la M1 (234,9%) y que la M2 (462,7%), habiendo diferencia estadística significativa entre estas. Igualmente, las 3 muestras fueron mayores que los aceites referenciales en cuanto a la concentración de éste ácido graso. El análisis estadístico del total de ácidos grasos saturados indica que la muestra M2 es mayor que la M1 y M3, mientras que las muestras M1 y M3 son iguales (> 0,05) en cuanto a éste parámetro. Cuando se analizó el total de ácidos grasos monoinsaturados, se encontró que la muestra M1 fue mayor que M2 y M3, mientras que las muestras M2 y M3 no fueron diferentes (< 0,05). Finalmente, cuando se compara el total de ácidos grasos poliinsaturados, se encuentra que las muestras M2 y M3 son iguales, y estas a su vez son mayores que la M1 (> 0,05); y al compararlas con los aceites referenciales, las muestras comerciales fueron menores que dos de los tres aceites en cuestión
Al comparar las muestras con un aceite de referencia se debe tener en cuenta que la calidad del aceite de pescado va a depender de que especies de peces se utilizaron para su elaboración, del sitio de recolecta de la materia prima, del proceso de elaboración y el tiempo de almacenamiento.
Los resultados del presente estudio indican que los valores y/o concentraciones, de las principales variables que cuantifican la calidad de un aceite de pescado, de las muestras analizadas se encuentran dentro de los rangos aceptables para su utilización en el sector acuícola.
En cuanto al análisis del sector camaronero para conocer el uso que le dan al aceite de pescado en sus granjas, el 100% manifestó que utilizan el aceite de pescado como aditivo enriquecedor del balanceado para mejorar su atractibilidad, principalmente durante la aplicación de fármacos, que generalmente se utilizan ante la presencia de enfermedades en el transcurso del cultivo.
Aidos, I., Vander Padt, A., Boom, R. & Luten, J. (2003a). Quality of Crude Fish Oil Extracted from Herring byproducts of Varying States of Freshness. Journal of Food Science 68: 458-465.
Aidos, I., Kreb, N., Boonman, M., Luten, J., Boom, R. & Vander Padt, A. (2003b). Influence of production process parameters on fish oil quality in a pilot plant. Journal of Food Science 68: 581-587.
Baker, R. & Davies, S. (1996). Oxidative nutritional stress associated with feeding rancid oil to African catfih, Clarias gariepinus (Burchell) and protective role of α-tocopherol. Aquaculture Research 27: 795-803.
Bockish, M. (1998). Fats and Oils Handbook. AOCS Press, Urbana, IL 61802. USA.
Cahu, CL., Cuzon, G. & Quazuguel, P. (1995). Effect of highly unsaturated fatty acids, alpha-tocopherol and ascorbic acid in broodstock diet on egg composition and development of Penaeus indicus. Comparative Biochemistry and Physiology, 112A (3-4): 417-424.
Camara, MR., Coutteau, P. & Sorgeloos, P. (1997). Dietary phosphatidylcholine requirements in larval and postlarval Penaeus japonicus Bate. Aquaculture Nutrition, 3(1): 39-48.
Clark, AE. & Lawrence, AL. (1988). Lecithin requirement of postlarval Penaeus vannamei. Journal of the World Aquaculture Society, 19: 23A.
D’Abramo, L., Conklin, D. & Akiyama, D. (1997). Crustacean Nutrition. Advances in World Aquaculture, Vol. 6. World Aquaculture Society, Baton Rouge, LA, USA. 628.
Daskalov, H., Robertson, P. & Austin, B. (2000). Influence of oxidized lipids in diets on the development of rainbow trout fry syndrome. Journal of Fish Diseases 23: 7-14.
Estévez, A., Sameshima, M., Ishikawa, M. & Kanazawa, A. (1997). Effect of diets containing low levels of methionine and oxidized oil on body composition, retina structure and pigmentation success of Japanese flounder. Aquaculture Nutrition 3: 201-216.
FAO. (2008) SOFIA Report, Fisheries and Aquaculture Department. Food and Agriculture Organization of the United Nations, Rome.
Gonzalez, F. & Pérez, M. (2002). Current status of lipid nutrition of Pacific white shrimp, Litopenaeus vannamei. In: Cruz-Suárez LE, Ricque-Marie D, Tapia-Salazar M, Gaxiola-Cortés MG, Simoes N (Eds.) Avances en Nutrición Acuícola VI. Memorias del VI Simposio Internacional de Nutrición Acuícola. 3 al 6 de septiembre 2002. Cancún, Quintana Roo, México.
Halver, J. & Hardy, R. (2002). Fish Nutrition. Academic Press, London, NW1 7BY, UK. 824.
Hardman, W. (2004). (n-3) Fatty Acids and Cancer Therapy. Journal of Nutrition 134: 3427S.
Hasler, C. (2002). Functional Foods: Benefis, Concerns and Challenges – A Position Paper from the American Council on Science and Health. Journal of Nutrition 132: 3772.
Herrera, E. & Zambrano, J. (2005). Efecto de la inclusión de lípidos con diferentes grados de oxidación sobre los parámetros productivos de Oreochromis niloticus variedad chitralada. Trabajo de grado (Zootecnia). Universidad Nacional de Colombia. Bogotá. 32.
Kanazawa, A., Teshima, S. & Ono, K. (1979). Relationship between essential fatty acid requirements of aquatic animals and the capacity for bioconversion of linolec acid to highly unsaturated fatty acids. Comparative Biochemistry and Physiology, 63B: 295-298.
Kayama, M., Hirata, M., Kanazawa, A., Tokiwa, S. & Saito, M. (1980). Essential fatty acids in the diet of prawn III. Lipid metabolism and fatty acid composition. Bulletin of the Japanese Society of Scientific Fisheries, 46: 483-488.
Koshio, S., Ackman, R. & Lall, S. (1994). Effects of Oxidized Herring and Canola Oils in Diets on Growth, Survival, and Flavor of Atlantic Salmon, Salmo salar. J. Agric. Food Chem. 42: 1164-1169.
Kris-Etherton, P., Harris, W. & Appel, L. (2003). Fish Consumption, Fish Oil, Omega-3 Fatty Acids, and Cardiovascular Disease. Arterioscler. Thomb. Vasc. Biol. 2003: 23; e20-e30.
Laohabanjong, R., Tantikitti, C., Benjakul, S., Supamattaya, K. & Boonyaratpalin, M. (2009). Lipid oxidation in fih meal stored under different conditions on growth, feed efficiency and hepatopancreatic cells of black tiger shrimp (Penaeus monodon). Aquaculture 286: 283-289.
Lewis-McCrea, L. & Lall, S. (2007) Effects of moderately oxidized dietary lipid and the role of vitamin E on the development of skeletal abnormalities in juvenile Atlantic halibut (Hippoglossus hippoglossus). Aquaculture 262: 142-155.
Lubzens, E., Khayat, M., Ravid, T., Funkenstein, B. & Tietz, A. (1995). Lipoproteins and lipid accumulation within the ovaries of penaeid shrimp. The Israeli Journal of Aquaculture- Barmidgeh, 47 (3-4): 185-195.
Middledich, B, Missler, S., Ward, D., McVey, J., Brown, A. & Lawrence, A. (1979). Maturation of penaeid shrimp: dietary fatty acids. Proceedings of the World Aquaculture Society, 10: 472-476.
Mourente, G., Díaz-Salvago, E., Bell, J. & Tocher, D. (2002). Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (Sparus aurata L.) fed dietary oxidised oil: attenuation by dietary vitamin E. Aquaculture 214: 343-361.
National Research Council (1993). Nutrient requirement of fish. National Academy Press, Washingtong D.C. 20418, 114.
Stephan, G., Guillaume, J. & Lamour, F. (1995) Lipid peroxidation in turbot (Scophthahus maximus) tissue: effect of dietary vitamin E and dietary n-6 or n-3 polyunsaturated fatty acids. Aquaculture 130: 251-268.
Rivero, G. (1980). Harina de pescado para consumo humano. Seminario I. Universidad Central de Venezuela, Facultad de Ciencias. Departamento de Tecnología de Alimentos. pp.30.
Rodríguez, B. (1980). Análisis de alimentos. Tomo I. Universidad Central de Venezuela, Caracas, Venezuela. 396.
Stickney, R. (2005). Aquaculture: an introductory text. CABI Publishing, UK.
Tacon, A. & Metian, M. (2008). Global overview on the use of fish meal and fish oil in industrially compounded aquafeeds: Trends and future prospects. Aquaculture 285: 146-158.
Tacon, G. (1992). Oxidation of dietary lipids. In: Nutritional fish pathology: Morphologycal signs of nutrient deficiency and toxicity in farmed fish. FAO Fish Technical Paper Nº 330. Rome. FAO. 75 pp.
Valenzuela, B., Sanhueza, J. & De la Barra, F. (2012).El aceite de pescado: ayer un desecho industrial, hoy un producto de alto valor nutricional. Revista Chilena de Nutrición. Vol. 39, N°2, pp.: 201-209.
Zaldívar-Larran, F. (2002). Las harinas y aceites de pescado en la alimentación acuícola. En: Cruz-Suárez LE, Ricque-Marie D, Tapia-Salazar M, Gaxiola-Cortés MG, Simoes N (Eds.). Avances en Nutrición Acuícola VI. Memorias del VI Simposio Internacional de Nutrición Acuícola. 3 al 6 de septiembre 2002. Cancún, Quintana Roo, México.
1. Universidad Técnica de Machala. Ingeniera Acuacultor. slita@utmachala.edu.ec
2. Universidad Técnica de Machala. Ingeniera Acuacultor
3. Universidad Técnica de Machala. Ingeniero Acuacultor
4. Universidad Técnica de Machala. Ingeniero Acuacultor
5. Universidad Técnica de Machala. Ingeniero Acuacultor
6. Universidad Técnica de Machala. Ingeniero Acuacultor