

Vol. 39 (Nº 26) Año 2018 • Pág. 18
Sonia Esperanza AGUIRRE FORERO 1; Nelson Virgilio PIRANEQUE GAMBASICA 2; Sandra Isabel RAMÍREZ GONZÁLEZ 3
Recibido: 12/02/2018 • Aprobado: 15/03/2018
RESUMEN: Se estudió la asociación entre los parámetros físicos y químicos del suelo, y el porcentaje promedio de infección (PPI) producido por Micosphaerella fijiensis Morelet, en fincas de la zona bananera del Departamento del Magdalena - Colombia. Los resultados establecieron asociación positiva entre el pH, Magnesio, CICE, Cu, Densidad aparente, Arcilla y Microporosidad con el PPI y negativa entre éste y Arena, Macroporosidad, Fósforo, Hierro, y Azufre, por lo que un manejo adecuado de estas variables en el cultivo puede reducir la incidencia del patógeno en la zona de estudio. |
ABSTRACT: The association between soil physical and chemical parameters in relation to the average percentage of infection (API) produced by Micosphaerella fijiensis Morelet was studied in farms of the Department of Magdalena – Colombia. Results showed a positive association between pH, Magnesium, Cation exchange capacity, Copper, Apparent density, Clay and Microporosity with API and negative relationship between API with Sand, Macroporosity, Phosphorous, Iron, and Sulfur, indicating that an adequate management of these variables in crop practices, can reduce the pathogen incidence in the study area. |
Los bananos y los plátanos son productos importantes para la alimentación de aproximadamente 400 millones de personas en el mundo. De Acuerdo con la Asociación de Bananeros de Colombia (Augura, 2016), en 2016 se exportaron cerca de 93,4 millones de cajas de banano, por un valor de 811 millones de dólares. Así mismo, este producto se cultiva en más de 48325 ha, de las cuales 34267 se encuentran en la zona del Urabá Antioqueño y 13140 al norte del Departamento del Magdalena y sur de la Guajira. Esta producción genera cerca de 60000 empleos directos e indirectos (Augura, 2016).
De acuerdo con diversos autores, las características agronómicas de los cultivares, el manejo de la fertilidad y la resistencia a las enfermedades son los principales determinantes del rendimiento al considerar el cultivo del banano (Stover, 2000; Martínez-Bolaños et al., 2012). Para Guevara (2015), la Sigatoka negra (M. Fijiensis Morelet) es el factor que genera los mayores costos en el cultivo del banano. Además, pese a los esfuerzos para su control, se pronostica una gran expansión en América Latina y el Caribe. Este factor unido a los cambios climáticos reducirá el ritmo de producción del banano, con lo cual se crea una inestabilidad en los precios (Leon, Llerena, & Molina, 2017; Hernández-Mansilla et al., 2016; Acorbat 2006).
Por otro lado, debido a la resistencia que presenta M. fijiensis a los fungicidas (Martínez-Bolaños et al., 2012; Manzo, Carrillo y Guzmán, 2012; Mehl & Manger-Jacob, 2015), existe un interés en buscar alternativas para el manejo de esta enfermedad (Guzmán y Villalta, 2007; Guzmán, 2012). Una de ellas es el manejo cultural fundamentado en la defoliación controlada para reducir el inóculo (Vargas, Murillo, Guzmán, Araya & Blanco, 2008), práctica avalada por CORBANA (Guzmán y Villalta, 2007) y N'Guessan, Hernández, Camara y Kone (2015), ya que no afecta la producción. Otras alternativas son el manejo preventivo a través de la aplicación constante y rotada de diferentes productos y el manejo biológico con Bacillus spp., Serratia spp., B. subtilis y B. amyloliquefaciens, bacterias secretoras de enzimas líticas quitinolíticas y glucanolíticas, que, aunque en condiciones controladas ofrecen buen resultado (in vitro e invernadero; Carr, 2009; Ceballos et al., 2012), en campo no reporta adaptabilidad. Así mismo, dentro de las alternativas que han surgido Castro et al. (2015) plantean que el Trichoderma harzianum es un antagonista potencial del patógeno que puede ser usado para este fin.
Por su parte, tanto Aguirre Piraneque y Rodríguez (2015) como Stover (2000) señalaron que la resistencia de las plantas a plagas está relacionada con la nutrición y el manejo del sistema. De esta manera, los patógenos preseleccionan las plantas que manifiestan alteraciones en su metabolismo, las atrae y se convierten en sustrato alimenticio y hábitat para su reproducción. Por esta razón, la absorción eficiente de los nutrientes es un aspecto que interviene en la respuesta metabólica de la planta a la enfermedad. Algunos registros indican que las condiciones climáticas predisponen el cultivo a la enfermedad M. fijiensis (Aguirre, Piraneque & Menjivar, 2012; Torrado y Castaño, 2008).
En este sentido, Aguirre et al. (2012) diferenciaron tres áreas de incidencia de la sigatoka en el Magdalena, donde la zona con menor porcentaje de infección (PPI) presentó menores promedios en precipitación (21,31 mm). No obstante, los autores no verificaron diferencias estadísticas, punto de coincidencia con el trabajo de Gómez (2010), quien reportó que no hay relación entre las variables climáticas y el PPI. Es posible que estos resultados se deban a las labores culturales (despunte, deshoje fitosanitario, cirugía, control de malezas y aplicaciones preventivas de fungicidas) que se realizan en la zona de estudio.
Lo mencionado hasta el momento sugiere una interacción entre el ambiente hospedero y el patógeno, lo cual determina la severidad con que la planta es afectada. Al respecto Díaz-Zorita, (2006) plantea que los desórdenes fisiológicos o las anormalidades estructurales son comunes en los cultivos comerciales del trópico. En estas áreas las plantas tienen estrecho contacto con las variables del entorno y existe una mayor dinámica en los procesos de comunicación entre el vegetal y el suelo (Siqueira y Moreira, 2006). Por ello, resulta necesario establecer si existen asociaciones entre los parámetros edáficos y el PPI.
Bazurto, Sánchez y Salinas (2017) sugieren que en el monocultivo de banano la fertilización debe ser proporcional a los requerimientos por etapa fenológica, si se espera obtener una mejor producción. Aguirre et al. (2012) sugieren que en el campo hay una distinción entre las plantas paridas y sin parir, por ejemplo, aunque las necesidades de nutrición son similares, las cantidades difieren y los excesos o deficiencias generan un desequilibrio que afecta la nutrición de la especie, sobre todo cuando se considera la variabilidad del terreno. Así mismo, el suelo no solo es un sustrato que ancla la planta, sino que también controla la absorción de nutrientes y la ecología del sistema, incide en la microbiología de la planta, regula los ciclos biogeoquímicos y el ciclaje de materia orgánica (MO), los flujos de gases y la disponibilidad de nutrientes entre otros. Por lo tanto, es una prioridad determinar las relaciones entre las propiedades edáficas y la severidad que genera M. fijiensis en la producción del banano, a fin de proporcionar un mejor manejo.
El presente trabajo se desarrolló en el departamento del Magdalena, el cual se sitúa en las coordenadas geográficas: 10º46’00” de latitud Norte y 74º8’00” de latitud Oeste, comprende 11.000 hectáreas situadas a 20 m.s.n.m. La temperatura media anual de este departamento es de 27ºC, la humedad relativa es de 82%, el índice de evaporación corresponde a 1500 mm año-1 y precipitación de 1371,7 mm año-1 (Bornacelly, 2009). Esta zona ha sido clasificada como bosque seco tropical (Bs.-T) y bosque muy seco tropical (Bms-T), de acuerdo con las zonas de vida de Holdridge, por lo cual ha sido reconocida por la producción de banano tipo exportación.
En esta región se seleccionaron ocho fincas con diferente PPI por medio del método de transectos: tres fincas (Ev, Ma y Ve) en la se ubican en una zona de baja incidencia; dos (Ov y Eu) en zona de media incidencia; y las tres restantes (Fo, Ol y Do) en la zona de alta incidencia. Las características climáticas de la región fueron descritas por Aguirre et al. (2012).
La zona donde se realizó el estudio está formada por estratos sedimentarios del período terciario (3-65 millones de años) de la Era Cenozoica, caracterizados por la presencia de areniscas y arcillas esquistosas amarillas, pardas, gris verdoso y azulado de las épocas del Oligoceno y Mioceno. También se hallan calizas calcáreas, areniscas calcáreas, gravilla, capas de carbón y calizas margosas del Plioceno. Esta formación tiene un espesor significativo y se caracteriza por su fauna miocénica, restos vegetales y capas lignitosas fuertemente bituminosas. El municipio de la Zona Bananera priorizó los suelos de clase I a III para el cultivo del banano, los cuales se encuentran localizados en valles, planos ondulados y planicies aluviales con pendientes que van de 0-10% y que son susceptibles de inundación. Así mismo, los suelos que corresponden a Dystric Haplustepts, Typic Dystrustepts, y Typic Endoaquepts, son dominados mineralogicamente por caolinita (50%), cuarzo (5-15%), feldespatos (5-15%), interestratificados (trazas), micas (5-30%), montmorillonita (30-50%) y vermiculita (5-30%) (Instituto Colombiano Agustín Codazzi, 2009; Aguirre et al., 2012).
Para la determinación del PPI se seleccionaron ocho fincas ubicadas en la zona sembradas con cultivares del grupo Cavendish (Gran enano y Valery) y con periodicidad mensual durante dos ciclos de cultivo se evaluó la severidad de Sigatoka en 100 plantas por finca, según la metodología de Stover modificada por Gauhl (1989). A partir de ello, se obtuvo la información sanitaria de las hojas más jóvenes en las plantas próximas a la floración. Posteriormente, se valoró la emisión foliar (número de hojas) de la planta, el estado de la hoja bandera, el nivel de infección de las hojas II, III y IV, y los estadios de desarrollo de Sigatoka descritos por Fouré (1985).
En la presente investigación se realizó un muestreo de 0-30 cm de profundidad para determinar las características físicas y químicas de los suelos (Cuadro 1). Las muestras obtenidas fueron procesadas en el Western Hemisphere Analytical Laboratory de Honduras.
Cuadro 1
Variables edáficas medidas y métodos empleados para establecer la relación
entre variables edáficas y PPI en el Departamento del Magdalena – Colombia.
Variable |
Unidad |
Método |
Densidad aparente ρa |
g cm-3 |
Método potenciométrico relación 1:2 |
Porosidad (total, Macrop - Microp) |
% |
Permeámetro de aire (DAIKI) |
Textura (Arena -A, Arcilla-Ar, Limo-L) |
% |
Pipeta |
pH |
Unid |
Método potenciométrico relación 1:2 |
CIC |
cmolc kg-1 |
Absorción atómica |
Fósforo –P |
|
Bray y Olsen, según pH |
Bases (Ca, Mg, K, Na) |
cmolc kg-1 |
Espectrofotometría de absorción atómica |
Carbono Orgánico- CO |
% |
Walkley & Black |
Materia Orgánica |
% |
CO x 1,723 |
Nitrógeno total –N |
% |
Digestión ácida |
Boro- B , Azufre - S |
mg kg-1 |
Extracto del suelo, espectrofotometría manual |
Aluminio -Al, Hierro -Fe, Manganeso-Mn, cobre- Cu, Zinc -Zn |
mg kg-1 |
Espectrofotometría de absorción atómica |
A partir de los registros de las variables en las unidades productivas se construyó una matriz en la que se relacionó el PPI y las características edáficas. Para determinar las relaciones existentes entre estas variables, se utilizó un análisis multivariado y de espacio-temporal en un diseño factorial (fincas y años). Igualmente, se calculó el porcentaje de infección (PPI), a partir de las variables edáficas: pH, CIC, Ca, Mg, K, Na, Al, P, S, N, Zn, Fe, Mn Cu, B y MO, A, Ar, ρa, Macrop y Microp (Cuadro 1).
Debido a que los datos no mostraron un comportamiento normal ni homogéneo, se recurrió al uso de pruebas no paramétricas, así como al análisis de correlación de Spearman para establecer el nivel de asociación entre las variables. Con el fin de estandarizar las magnitudes y las unidades medidas las variables fueron ordenadas por medio de distancias euclidianas y la función R Scale. Además, con el fin de reducir la dimensionalidad de los datos se usó un análisis de componentes principales. La diferencia entre las fincas y los años (factores) fue evaluada con PERMANOVA (McCune y Grace, 2002) a dos vías y para determinar la forma de variación del PPI por finca, las variables se transformaron en un espacio canónico. Esto último se realizó con el objetivo de explicar su contribución en el PPI. Para llevar a cabo los análisis antes mencionados se utilizó el programa estadístico R versión 3.02 (R Development Core Team 2015 disponible en: www.r-project.org).
Luego del análisis de los datos (Cuadro 2) se determinó la relación entre las variables y el PPI. La información presentada en la Cuadro 2 mostró que las fincas Ev, Ma y Ve reportaron menores valores del PPI, con 1.99, 1.96 y 2.35%, respectivamente, de manera que resultan tolerantes para la producción bananera. Por su parte, que las fincas Ol (3.89%) y Fo (3.67%), presentaron altas tasas de PPI (superiores al 2%), cifra que sugiere que el productor debe tomar medidas de control.
Tal como lo muestra la Cuadro 2, el análisis de correlación evidenció diferentes niveles de asociación, lo que permitió seleccionar variables con mayor relación para el modelo de regresión múltiple y sugiere la importancia de la tolerancia a la Sigatoka negra. Los resultados muestran que variables como K, P, Fe y S presentaron asociación inversa con el PPI, mientras que el pH, Mg y Cu, mostraron correlación positiva.
Así mismo, en las fincas con bajo nivel de PPI la relación K: Mg es normal, ya que se mantiene en rangos de entre 0.2-0.4. Por el contrario, los valores obtenidos en las fincas con alto nivel de PPI son cercanos a 0.1, lo que permite inferir que estos suelos podrían estar fijando el K (Bernstein et al., 2011). Igualmente, las altas concentraciones de Mg generan deficiencia inducida de K, fenómeno explicado por Cakmak (2005) y Marschner (2003), lo cual puede incrementar la susceptibilidad del vegetal al patógeno. Por su parte, las variables ρa, Ar y Microp presentaron asociación positiva con el PPI.
Cuadro 2
Correlación de Spearman entre PPI y las variables evaluadas
a nivel edáfico en la zona bananera del Magdalena (Pr<0,001).
Variable |
Identificador |
r |
P-valor |
Macroporosidad (%) |
Macrop |
-0,44 |
*** |
Microporosidad (%) |
Microp |
0,72 |
*** |
Densidad aparente |
ρa |
0,69 |
*** |
Arcilla (%) |
Ar |
0,73 |
*** |
Arena |
A |
-0,55 |
*** |
Fósforo (mg kg-1) |
P |
-0,34 |
*** |
Hierro (mg kg-1) |
Fe |
-0,34 |
*** |
Azufre (mg kg-1) |
S |
-0,28 |
*** |
pH (unid) |
pH |
0,30 |
*** |
Magnesio (cmolc kg-1) |
Mg |
0,30 |
*** |
Potasio (cmolc kg-1) |
K |
-0,45 |
*** |
CIC (cmolc kg-1) |
CICE |
0,35 |
*** |
Cobre (mg kg-1) |
Cu |
0,42 |
*** |
*** Correlaciones son significativas al 0,01
De acuerdo con Higuita y Sánchez (2012) los extremos texturales (arcilla y arena) son factores que limitan el crecimiento de la raíz. En las estructuras pesadas se presenta alta densidad aparente y resistencia a la penetración de las raíces, lo que restringe la disponibilidad del agua y absorción de los nutrientes por parte de la planta. De esta manera, los extremos de pH y los altos contenidos de Na y Al, Fe y Mn solubles causan toxicidad y deterioran las raíces de la planta del banano.
Entre los minerales finos se destaca la presencia vermiculita, la cual fija el K entre sus espacios interlaminares (Cornelis y Cornelius, 2007). Este hallazgo junto al predominio de los microporos en el área de estudio, permite establecer que los suelos se han sometido a labranza intensiva, lo que restringe la redistribución del agua y la circulación del aire dentro del perfil. Así mismo, la conductividad hidráulica moderadamente lenta y la porosidad dominada por microporos, conlleva a deducir que se genera estrés por agua y se interfiere en la absorción de los nutrientes.
Al respecto Amézquita, Chávez, Molina, Hoyos y Galvis (2003) afirman que los suelos con textura arcillosa tienen pobres condiciones de labranza, baja permeabilidad, alta retención de humedad y son susceptibles a la erosión hídrica, ya que el contenido de arcilla está directamente asociado con la densidad aparente y la conductividad hidráulica del suelo. Igualmente, la densidad se relaciona con la posibilidad de expansión y crecimiento de las raíces de la planta e incide en los contenidos de MO (Amézquita et al., 2003). A partir de los resultados se determinó que estos suelos almacenan láminas de agua > 5mm cm-1 (> 11mm cm-1 en la zona de alto PPI y < de 8 mm. cm-1 en la zona de bajo PPI), lo cual resulta por afectar la circulación del aire (Farfan e Hincapie, 2014) y altera el metabolismo vegetal. Aunque estas características generan condiciones que incrementan la disponibilidad de Fe2+, el cual llega a niveles tóxicos o perjudiciales para las plantas), también favorece la incidencia de patógenos como M. fijiensis (Agrios, 2005).
Los resultados obtenidos evidencian mayores niveles de microporosidad en las fincas Fo y Ol, lo que se relaciona con agregados de menor tamaño y síntomas de marchitamiento en las plantas, aun cuando el suelo se encuentre húmedo. A su vez, cuando el flujo de oxígeno se mejora la respuesta de la planta es favorable, lo cual coincide con lo mencionado por Marschner (2003). Por el contrario, cuando la circulación del oxígeno se limita, los procesos de fermentación que originan la muerte de los ápices se incrementan (Aguilar, Turner, Gibbs, Armstrong & Sivasithamparam, 2003; Turner, Fortescue & Thomas, 2007). Por su parte, autores como Serrano (2003) plantean que la pérdida de 110 gramos de raíces funcionales por planta disminuye la productividad de 60 a 140 cajas ha-1 año. Los resultados de la presente investigación sugieren que las áreas con mayor concentración de vermiculita y alto porcentaje de microporos se correlacionan positivamente con el PPI, posiblemente porque afecta la disponibilidad del K.
Respecto a la porosidad autores como Spann y Schumann (2010), y Dordas (2008) plantean que algunas características ambientales limitan la tolerancia a infecciones y el crecimiento del vegetal. Uno de los enfoques utilizados en la agricultura sostenible es el aumento de la disponibilidad de elementos y mejora de las características físicas del suelo, lo que provee balance hídrico y energético, fundamental en la absorción de los nutrientes. Por esta razón, si las plantas no están correctamente hidratadas y la circulación de gases como el oxígeno es deficiente en el área de influencia de raíces, se disminuye la nutrición del vegetal (Aguirre et al., 2012).
Se ha observado que el porcentaje óptimo para el desarrollo normal de las plantas en un suelo con porosidad total de 50%, debe ser de 15% de macroporos o agua drenable, 30 % de mesoporos o agua aprovechable y 5% de microporos o agua residual (Amézquita et al., 2003). De acuerdo con esta interpretación, los resultados presentados en la Cuadro 3 muestran que los microporos en los suelos con mayor PPI se encuentran por encima de los parámetros ideales. Esto puede explicar la baja capacidad de los suelos para almacenar agua aprovechable y de aporte adecuado de los nutrientes, lo que se traduce en mayor severidad de daño por sigatoka negra.
Por su parte, los macroporos regulan el crecimiento del sistema de raíces y favorecen el intercambio de gases, lo cual es muy similar al efecto producido por el suministro de O2 y CO2. La difusión es el mecanismo más importante para la circulación de oxígeno y la velocidad del proceso depende del gradiente de concentración del mismo, es decir, la difusión depende del espacio poroso no ocupado por agua. Amézquita et al. (2003) plantea que el incremento de la macroporosidad a través de las prácticas de cultivo y la adición de MO, aumenta la producción en suelos arcillosos, de manera que a medida que se aumenta la aireación, crecen los rendimientos. En condiciones óptimas los macroporos no deben retener agua, su función primordial es el flujo gaseoso. Además, los nutrientes esenciales, como el fósforo (P) y el potasio (K), se mueven hacia la raíz casi exclusivamente por procesos de difusión (Cochrane y Cochrane, 2009). En estas condiciones, es necesario asegurar las reacciones de absorción y desorción (Violante y Caporale, 2015), y la disponibilidad de nutrientes, lo que repercute en la producción de efectos de tolerancia (Jiménez, 2008).
Otro aspecto que es necesario mencionar es que, aunque existe disponibilidad de riego en el área, éste algunas veces es excesivo y en otras, escaso, lo cual genera estrés en el cultivo. La falta de continuidad porosa en el suelo produce encharcamientos y condiciones reductoras, fenómeno que incrementa la disponibilidad de Fe y Mn, los cuales pueden ser tóxicos para la planta en determinados ciclos (Aguilar et al., 2003; Turner et al., 2007). De esta manera, el presente estudio encontró que las áreas con mayor concentración de vermiculita y mayor porcentaje de microporos se relacionan positivamente con el PPI, posiblemente porque inciden sobre la disponibilidad del K.
Por otro lado, el análisis de componentes principales (ACP) permitió seleccionar cuatro componentes que explicaron 73% de la variación total. En la primera componente (CP1) se expresaron con mayor peso las variables ρa, Microp, contenido de Ar y de A, mientras que en lal CP2 se encontró magnesio (Mg+2) con mayor relevancia. En la CP3 se destacaron los contenidos de fósforo (P), Hierro (Fe) Azufre (S) y Potasio (K+) y en la CP4 prevaleció el cobre (Cu).
El procedimiento de ordenación mostró que las fincas Ma, Ev, Ve se diferencian de las demás. La varianza explicada por los dos primeros componentes de la Figura 1 fue de 49.1%, y se observan patrones de ordenación adecuados. La representación geométrica de las variables es significativa, lo cual se representa por las flechas que parten de un mismo origen y que poseen una longitud igual a la desviación estándar de la variable. De esta manera, los ángulos pequeños significan una correlación positiva alta, los ángulos cercanos a 90° ausencia de correlación y los ángulos cercanos a 180° correlación negativa. En la
Figura 1 se observa que el PPI se asoció de forma lineal con diferentes variables, por ejemplo directamente con el pH, el Ca, el Mg, el Cu, el Microp, el Ar y ρa, e inversamente con el K, S, la Macrop y A.
Los resultados de la prueba PERMANOVA mostraron diferencias en las variables entre fincas, años y su interacción. De esta manera se reporta: (SeudoF(Año)=3390.7; g.l.= 1; valor p= 0.001); (SeudoF(Finca)=1791.2; g.l.= 7; valor p= 0.001); (SeudoF(Año:Finca)=2516; g.l.= 7; valor p= 0.001). Estos resultados sugieren que las variables edáficas influyen en el PPI, por lo que deben ser identificadas. En este sentido, se acudió al análisis discriminante canónico asignando igual probabilidad de clasificación por Ley de Bayes, a partir del cual se observó que la probabilidad de discriminación de cada uno fue de 0,125 y el porcentaje de varianza explicado por la primera discriminante fue del 99.7%.
Cuadro 3
Contenidos y niveles de nutrientes edáficos y porcentaje promedio de infección (PPI)
en suelos de fincas bananeras (Do, Fo, Ol, Eu, Ov, Ev, Ma y Ve) con presencia
de sigatoka negra en las zonas de alta (A), media (M) y baja (B)
incidencia en el Departamento del Magdalena - Colombia.
Zona/Finca |
PPI |
pH |
Al |
CE |
MO |
Ca |
Mg |
K |
Na |
P |
Zn |
Fe |
Mn |
Cu |
B |
S |
CIC |
ρa |
Microp |
Macrop |
Ar |
A |
A |
3,60 |
6,23 |
0,09 |
0,88 |
1,84 |
8,16 |
2,88 |
0,42 |
0,16 |
54,27 |
3,80 |
215,58 |
56,16 |
42,82 |
0,47 |
25,56 |
13,33 |
1,30 |
33,02 |
12,13 |
39,07 |
22,65 |
Do |
3,22 |
6,08 |
0,10 |
1,34 |
1,81 |
9,57 |
4,23 |
0,53 |
0,24 |
53,09 |
2,82 |
324,75 |
62,07 |
27,61 |
0,17 |
52,48 |
11,50 |
1,25 |
18,66 |
16,88 |
35,44 |
13,23 |
Fo |
3,68 |
5,75 |
0,10 |
0,46 |
2,60 |
6,12 |
1,59 |
0,33 |
0,08 |
69,72 |
3,49 |
106,23 |
9,12 |
44,15 |
1,05 |
13,48 |
16,71 |
1,27 |
39,78 |
9,80 |
40,82 |
27,18 |
Ol |
3,89 |
6,92 |
0,05 |
0,89 |
1,04 |
9,01 |
2,95 |
0,40 |
0,18 |
38,40 |
5,14 |
226,07 |
102,19 |
56,72 |
0,14 |
11,70 |
11,43 |
1,38 |
40,07 |
9,91 |
40,82 |
27,18 |
M |
3,26 |
6,39 |
0,03 |
1,02 |
2,26 |
10,11 |
3,59 |
0,38 |
0,21 |
54,85 |
4,11 |
256,45 |
63,57 |
49,78 |
0,32 |
28,18 |
14,17 |
1,25 |
18,69 |
17,22 |
36,08 |
13,87 |
Eu |
3,49 |
6,17 |
0,03 |
1,77 |
1,54 |
9,99 |
3,04 |
0,60 |
0,14 |
41,98 |
3,55 |
334,75 |
73,36 |
54,87 |
0,09 |
10,46 |
13,84 |
1,25 |
18,84 |
17,40 |
35,44 |
13,23 |
Ov |
3,04 |
6,58 |
0,03 |
0,35 |
2,92 |
10,22 |
4,08 |
0,18 |
0,27 |
66,48 |
4,62 |
185,65 |
54,71 |
45,17 |
0,52 |
44,20 |
14,46 |
1,25 |
18,54 |
17,06 |
36,67 |
14,45 |
B |
2,10 |
5,48 |
0,11 |
1,03 |
1,80 |
6,49 |
1,63 |
0,72 |
0,15 |
78,83 |
5,81 |
333,51 |
41,40 |
13,17 |
0,20 |
28,17 |
9,12 |
1,14 |
9,86 |
17,54 |
25,44 |
69,35 |
Ev |
1,99 |
5,31 |
0,13 |
1,60 |
1,71 |
7,05 |
1,75 |
0,86 |
0,18 |
69,04 |
6,27 |
365,75 |
47,76 |
21,70 |
0,09 |
26,96 |
9,85 |
1,15 |
9,88 |
17,62 |
25,60 |
69,34 |
Ma |
1,97 |
5,70 |
0,08 |
0,40 |
1,94 |
5,69 |
1,51 |
0,41 |
0,15 |
91,68 |
4,85 |
247,99 |
37,06 |
8,80 |
0,38 |
28,48 |
8,26 |
1,08 |
9,72 |
17,53 |
26,20 |
69,28 |
Ve |
2,35 |
5,40 |
0,14 |
1,13 |
1,75 |
6,77 |
1,64 |
0,90 |
0,13 |
74,79 |
6,38 |
390,55 |
39,97 |
9,77 |
0,12 |
28,96 |
9,34 |
1,20 |
9,97 |
17,49 |
24,54 |
69,44 |
-----
Figura 1
Ordenación de las variables edáficas y fincas de la zona bananera en el departamento
Magdalena con presencia de sigatoka. La parte izquierda de la figura muestra el nivel
de relación de las fincas con base en los diferentes muestreos, mientras que en la parte derecha
se muestra la proyección vectorial de las variables medidas y su relación con PPI.

La Figura 2, representa la primera función discriminante (Can1) que captura el 86.5% de la varianza. A la izquierda de la figura se aprecia que las fincas Ma, Ev y Ve cuentan con menor nivel de PPI, lo que las diferencia de las demás. Por su parte, la información dispuesta en la caja derecha muestra que las variables que más caracterizan a estas fincas son la macroporosidad, el contenido de fósforo (P), hierro (Fe) y Azufre (S). Las fincas Fo y Ol con mayor PPI discrepan del resto y se relacionan con las variables microporosidad, magnesio (Mg), cobre (Cu) y pH.
A partir de un modelo lineal multivariado se estableció un análisis discriminante canónico (ADC) para los dos periodos, con el que se distinguen tres zonas según la expresión del daño por M. fijiensis y se visualizan las variables que caracterizan cada finca. Por ejemplo, la finca Ol con alto PPI se asocia con altos valores en pH y Cobre (Cu) en el suelo, así mismo se aprecia como el PPI se comporta de manera lineal positiva con Microp, Mg y Cu, entre otras. A partir de estos resultados se verificó que existen variables edáficas que inciden sobre el porcentaje de infección (PPI) por periodo.
Figura 2
Contribución de las variables a la capacidad discriminante del análisis entre PPI y l
as propiedades edáficas en cultivos de banano de la zona bananera del Magdalena.
La puntuación canónica (izquierda) representa sus diferencias. La estructura (derecha)
corresponde con la proyección vectorial de las variables edáficas para identificar su
relación con las fincas.
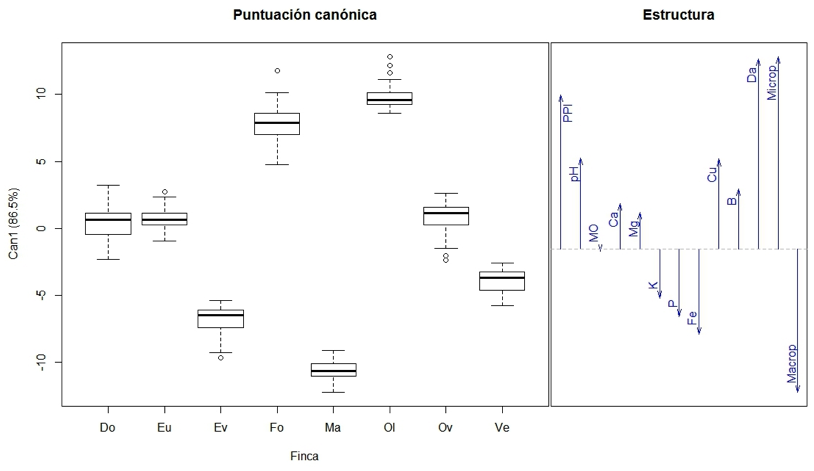
Los datos encontrados para el año 1, sugieren una relación directa entre el porcentaje de microporos, el contenido B en el suelo y el porcentaje de materia orgánica, resultado que se mantiene cuando se analiza el año 2. Este aspecto corrobora la existencia de una relación directa entre la microporosidad, el contenido de B, Cu y pH del suelo. Tal como se puede evidenciar, en los dos años el porcentaje de microporos, B, Cu y pH en el suelo permanecen estables, siendo las fincas Fo y Ol las que presentan mayor PPI. Es importante resaltar que existe una relación directa entre el PPI con Microp, B y Cu, e inversa con Macrop y Fe.
Dordas (2008) plantea que la presencia de Mg disminuye los contenidos de Ca en la planta de maní y la predispone al Rhizoctonia y Pythium. En este sentido, Aguirre, Menjivar y Piraneque (2006) reportaron que los incrementos en los contenidos de magnesio en cebolla de bulbo, aumentaron el porcentaje del daño generado por el Sclerotium cepivorum. Esta situación se relaciona con los hallazgos de la presente investigación respecto a la dinámica de este elemento. Marschner (2003) señala que la relación K:Mg es importante en la reducción del daño producido por patógenos. Por su parte, Almeida et al. (2015) y Cochrane y Cochrane (2009) enfatizan que el K es fundamental en la nutrición de la planta dada su importancia en la turgencia, transporte de carbohidratos, incremento de la fotosíntesis y en la producción de hormonas.
En la presente investigación se observó un nivel adecuado de la relación K:Mg en la zona con menor PPI (K:Mg=0,44), mientras que las zonas de con más altos valores en PPI se encontraron valores bajos (K:Mg=0,11 y K:Mg= 0,15, respectivamente), lo que produce deficiencia inducida de K por contenidos altos de Mg quien ocupa la mayor parte de los sitios específicos de absorción. Huber y Haneklaus (2007) plantean que la deficiencia de nutrientes generan efectos negativos sobre la tolerancia a enfermedades, específicamente cuando la relación Ca:Mg:K no presenta el balance adecuado. La relación inversa entre PPI y K encontrada en el presente estudio permite inferir que en la medida en la que el nutriente se incremente en el suelo hay mayor posibilidad de absorción y por tanto, mejora la nutrición de la planta y ayuda a tolerar el patógeno.
En cuanto al efecto generado por el cobre y el hierro en la reducción de la severidad de las enfermedades vegetales, Marschner (2003) señala que puede ser atribuido a la relación que existe con la fisiología y bioquímica de la planta. Por otro lado, los micronutrientes pueden afectar indirectamente la tolerancia a las enfermedades cuando se encuentran deficientes, en cuyo caso el vegetal es mejor sustrato alimenticio y se vuelve atractivo para el patógeno (Rengel, 2015).
Aguirre, Menjivar y Piraneque (2005), y Aguirre et al. (2006) reportaron que el incremento en los contenidos de Cu en el suelo aumentó el porcentaje de daño por S. cepivorum. Al respecto, Marschner (2003) y Saykhul et al. (2014) afirman que el suministro de cobre vía foliar es más eficiente en el control de enfermedades que aquel que se aplica vía edáfica. Este efecto es atribuido a que la mayor parte del cobre aplicado al suelo se une fuertemente a la matriz del mismo. Los resultados obtenidos en la presente investigación plantean una relación directa entre el contenido de Cu en el suelo y el PPI, lo que permite deducir que aplicaciones altas de Cu como anticriptogámico afecta la microbiología del suelo. Por su parte, Malavolta (2006) y, Chen y Liu (2005) presentan algunos ejemplos del efecto del cobre sobre enfermedades y el papel fungistático que tiene debido a su función en la síntesis de lignina, lo cual dificulta la entrada del patógeno en la célula.
Con respecto a este punto, Agrios (2005), afirma que el Cu aplicado en el suelo es más efectivo y suprime la presencia de hongos. Sin embargo, los resultados encontrados por Aguirre et al. (2006) permiten plantear que las aplicaciones continuas de cobre, como anticriptogámico, controla y reduce las poblaciones microbianas del suelo, ya que perturba la rizósfera. Por esta razón, su aplicación por largos periodos favorece los organismos patógenos.
Existen algunas referencias de la importancia del hierro en el control y la resistencia a enfermedades vegetales. Por ejemplo, Graham y Webb (1991) reportaron una reducción de la severidad de los efectos causados por la roya y la pudrición en el trigo, el Sphaeropsis malarum en el manzano y el peral, del Olpium brassicae en el repollo y del Colletotrichum musae en el banano. Por otro lado, la relación inversa observada en el presente estudio puede ser resultado de que el Fe promueve antimicosis. Por esta razón Marschner (2003) enfatiza en la importancia de este elemento como precursor de pigmentos como la protoclorofila, de manera que su deficiencia afecta notoriamente el proceso fotosintético.
No obstante, existen patógenos con altos requerimientos de este elemento, ejemplo de ello es el Fusarium. El comportamiento del Fe difiere de los demás micronutrientes como el Mn, Cu y B, ya que los requerimientos por parte de los microorganismos son más bajos. En consecuencia, aunque las aplicaciones de estos últimos elementos generalmente benefician al hospedero (planta), aún no se tiene certeza sobre la contribución de las aplicaciones del hierro, sobretodo en la reducción del accionar del patógeno en los vegetales (Dordas, 2008).
Finalmente, El modelo obtenido en el análisis de regresión múltiple corroboró el comportamiento del PPI frente a las variables medidas con alto grado de confiabilidad (R2=0,9476 C (p)=6,17) (P<0,0001). Por tanto, la ecuación que mejor explicó el comportamiento del PPI es:
A partir de este modelo se puede decir que el PPI está fuertemente influenciado por la Microporosidad, el pH, Fe y Cu.
A partir de los resultados mostrados, de su análisis y de su discusión se pueden obtener las siguientes conclusiones: 1) Existe una asociación positiva entre la microporosidad, los contenidos de arcilla, alta densidad aparente, pH y los contenidos de cobre, hierro, magnesio y calcio, con el porcentaje promedio de infección (PPI) en el cultivo de banano en la zona de estudio. 2) El manejo del suelo y de los programas de fertilización son estrategias que pueden colaborar en el manejo de la severidad de sigatoka negra, enfermedad que ha logrado adaptarse a diferentes condiciones y se ha convertido en una amenaza para la producción de banano. 3) Las propiedades físicas son un componente importante en el proceso de nutrición vegetal y en la tolerancia a los patógenos.
Acorbat (15 a 20 de octubre de 2006). Impacto y manejo de la sigatoka negra en el cultivo de banano de exportación de Joinville. Brasil: Santa Catarina.
Agrios G., N. (2005). Plant Pathology. USA: Elsevier Academic Press.
Aguilar E., A., Turner D., W., Gibbs D., J., Armstrong, W. & Sivasithamparam K. (2003). Oxygen distribution and movement, respiration and nutrient loading in banana roots (Musa spp. L.) subjected to aerated and oxygen-depleted environments. Plant Soil, 253(1), 91–102.
Aguirre S., Piraneque N. & Menjivar J. (2012). Relación entre las propiedades edafoclimáticas y la incidencia de Sigatoka negra (Mycosphaerella fijiensis Morelet) en la zona bananera del Magdalena-Colombia. R. I. A. A., 3(2), 2145-609.
Aguirre S., Piraneque N., & Rodríguez J. (2015). Relationship between the nutritional status of banana plants and black Sigatoka severity in the Magdalena region of Colombia. Agron. Colomb., 33(2), 348-355.
Aguirre S., Menjivar J. & Piraneque N. (2006). Relación entre la nutrición mineral y la severidad del daño ocasionado por pudrición blanca en cebolla de bulbo. Acta Agron., 55(4), 21-28.
Aguirre S., Menjivar J. & Piraneque N. (2005). Relación entre nutrición vegetal y enfermedades vegetales. R. I. A. A. 4(2), 24-35.
Amézquita E. L. F., Chávez D.L., Molina P., Hoyos & Galvis J. H (13-18 Julio de 2003). Susceptibility to compaction of improved soils (Oxisols) in the Eastern Plains of Colombia. International Soil Tillage Research Organisation Conference, Proceedings of ISTRO-16 “Soil Management for Sustainability”. Brisbane, Australia.
Asociación de Bananeros de Colombia (2016). En la VI Reunión Técnica Bananera Santa Marta, AUGURA. Recuperado de: http://www.augura.com.co/cenibanano/reunion-tecnica-bananera/
Bazurto J. T., Sanchez J. D. & Salinas D. G. (2017). Nutrient accumulation models in the banana (Musa AAA Simmonds cv Williams) plant under nitrogen doses. Acta Agron., 66(3): 391-396.
Bernstein N., Ioffe M., Luria G., Bruner M., Nishri Y., Philosoph-Hadas S., Salim S., Dori I. & Matan E. (2011). Effects of K and N Nutrition on Function and Production of Ranunculus asiaticus. Pedosphere, 21(3), 288–301.
Bornacelly H. (2009). Estudio del ciclo de vida de Mycosphaerella fijiensis en tres clones de banano (Musa aaa) en tres regiones de la zona bananera del Magdalena (Tesis de maestría) Universidad Nacional de Colombia, Colombia.
Cakmak I. (2005). The role of potassium in alleviating detrimental effects of abiotic stresses in plants. Journal of Plant Nutrition Soil Sciences, 168, 521-530.
Carr C. (2009). Aislamiento y selección de hongos antagonistas en plantaciones de banano para el combate biológico de la Sigatoka negra (Tesis de pregrado). Instituto Tecnológico de Costa Rica. San Carlos, Costa Rica.
Ceballos I., Mosquera S., Angulo M., Mira J., Argel L. E., Uribe-Velez D., Romero T., Orduz-Peralta S. & Villega, V. (2012). Cultivable bacteria population associated with leaves of banana and plantain and their antagonistic activity against Mycosphaerella fijiensis. Environmental Microbiology, 64(3), 641-53.
Chen L. & Liu Z. (2005). Rapid effect of copper on lignin biosynthesis in soybean roots. Plant Sci., 168, 855-861.
Cochrane T. & Cochrane T. (2009). The vital role of potassium in the osmotic mechanism of stomata aperture modulation and its link with potassium deficiency. Plant Signaling & Behavior, 4, 240–243.
Cornelis K. & Cornelius S. (2007). Manual de Mineralogía. Barcelona:Editorial Reverté.
De Almeida H. J., Cruz F. J. R., Pancelli M. A., Flores R. A., Vasconcelos R. de L., & de Mello Prado R. (2015). Decreased potassium fertilization in sugarcane ratoons grown under straw in different soils. A. J. C. S., 9(7), 596.
Díaz-Zorita M. (2006). Impacto de la fertilidad del suelo sobre las enfermedades en el Cultivo de soja. Presentado en el III Congreso de Soja del MERCOSUR. Rosario Argentina.
Dordas C. (2008). Roles of nutrients in controlling plant disease in sustainable agriculture. A review. Agronomy for Sustainable Development, 28, 33-46.
Farfan F. & Hincapie E. (2014). Valoración de la sostenibilidad ambiental mediante indicadores de calidad del suelo en sistemas de producción de café en Colombia. Cenicafé, 62(1), 100-118.
Fouré E. (1985). Black streak disease of bananas and plantains (Mycosphaerella fijiensis, Morelet). Study of the symptoms and stages of the disease in Gabon. Paris: IRFA.
Gauhl F. (1989). Untersuchunge zurepidemiologie und okoloigie de Schuwargen Sigatoka krankheit (Mycosphaerella fijiensis Morelet) an kockbonanen (musa sp) in Costa Rica (Tesis de grado). Universidad Gottingen, West Germany.
Gómez D. (2010). Influencia del balance nutricional con micronutrientes (B-Zn) en la productividad del cultivo del banano (Musa AAA Simmonds) y la severidad de la Sigatoka negra (Mycosphaerella fijiensis Morelet) (Trabajo de grado). Universidad de la Amazonía, Colombia.
Graham R. & Webb M. (1991). Micronutrients and disease resistance and tolerance in plants. En J. J. Mortvedt, F. R. Cox, L. M. Shuman & R. M. Welch (Eds.), Micronutrients in Agriculture (pp. 329-370). Wisconsin Soil Science Society of America.
Guevara R. (2015). Analizar los costos de producción de una caja de banano convencional de la hacienda Los Tamarindos del sitio Jumón Santa Rosa. Recuperado a partir de http://repositorio.utmachala.edu.ec/handle/48000/2008
Guzmán M; Villalta R. (2007). Efecto del método de control de malezas sobre el desarrollo de la Sigatoka negra y la producción del banano (Musa AAA, cv. Grande naine). Corbana, 33(60), 50-52.
Guzmán M. (2012). Control biológico y cultural de la Sigatoka-negra. Presentado en el 45º Congresso Brasileiro de Fitopatologia. Manaus, Brasil. Disponible en: http://media.wix.com/ugd/805a0f_e3dab4225ec1c08d4d738455cddd0a57.pdf
Hernández-Mansilla A. A., Sorí-Gómez R., Valentín-Pérez Y., López-Mayea A., Córdova-García O., & Benedico-Rodríguez O. (2016). Sigatoka negra (Mycosphaerella fijiensis Morelet) y seguridad alimentaria. Escenarios bioclimáticos en bananos bajo efecto del cambio climático en Ciego de Ávila, Cuba. J. Selva Andina. Biosph., 4(2), 59-70.
Higuita C. & Sánchez J. (2012). Importancia de las propiedades físicas y químicas del suelo para la productividad bananera (AUGURA-CENIBANANO, II Reunión técnica bananera). Apartadó: AUGURA.
Huber D. & Haneklaus S. (2007). Managing Nutrition to Control Plan Disease. Landbauforschung Völkenrode, 4(57), 313-322
Instituto Colombiano Agustín Codazzi (2009). Estudio general de suelos y zonificación de tierras. Departamento del Magdalena. Escala 1:100000. Bogotá: IGAC.
Jiménez M. 2008. Effect of the nutritional status of banana (Musa spp.) on leaf disease infestation by Mycosphaerella fijiensis Morelet in Ecuador (Tesis Doctoral). Katholieke Universiteit, Leuven.
Leon, M., Llerena, C., & Molina, E. (2017). Reaching development from innovation: a strategic look from Latin America. Revista ESPACIOS, 38(59). Retrieved from http://www.revistaespacios.com/a18v39n03/18390327.html
Malavolta E. (2006). Manual de nutrição mineral de plantas. São Paulo: Editora Agronomica Ceres Ltda.
Manzo G., Carrillo H. & Guzmán S. (2012). Análisis de la Sensibilidad in vitro de Mycosphaerella fijiensis, Agente Causal de la Sigatoka Negra del Banano a los Fungicidas Benomyl, Propiconazol y Azoxistrobin. Revista Mexicana de Fitopatología, 30(1), 81-85.
Marschner H. (2003). Mineral Nutrition of Higher Plants. London: Academic Press.
Martínez-Bolaños L., Téliz-Ortiz J., Rodríguez-Maciel C., Mora-Aguilera A., Nieto-Ángel D., Cortés-Flores I., Mejía-Sánchez D., Nava-Diaz C. & Silva-Aguayo G. (2012). Resistencia a fungicidas en poblaciones de Mycosphaerella fijiensis del sureste mexicano. Agrociencia, 46 (7), 707-17.
McCune B., & Grace J. (2002). Analysis of Ecological Communities. Oregon: Gleneden Beach.
Mehl A., & Manger-Jacob F. (2015). Banana Diseases. En H. Ishii & D. W. Hollomon (Eds.) Fungicide Resistance in Plant Pathogens (pp. 467–79). Japan: Springer
N'Guessan P. H., Hernandez F., Camara B., & Kone D. (2015). Comparison of two defoliation methods in the control of black Sigatoka disease (Mycosphaerella fijiensis Morelet) in industrial banana plantations in Côte d'Ivoire. I. J. A. I. R., 4(1): 110-114.
Rengel Z. (2015). Availability of Mn, Zn and Fe in the rhizosphere. J. soil Sci. Plant Nutr., 15(2), 397-409.
Saykhul A., Chatzissawidis C., Therios I., Dimassi K., & Chatzistathis T. (2014). Growth and nutrient status of olive plants as influenced by foliar potassium applications. J. soil Sci. Plant Nutr., 14(3), 602-615. https://doi.org/10.4067/S0718-95162014005000048
Serrano E. (2003). Relationship between functional root content and banana yield in Costa Rica. En D.W. Turner & F. E. Rosales (Eds.). Banana root system: towards a better unserstanding for its productive management. Presentado en el International Symposium, San Jose, Costa Rica, 3-5 November 2003.
Siqueira J. & Moreira F. (2006). Microbiologia e Bioquímica do Solo. Lavras: Ufla.
Spann T. & Schumann A. (2010). Mineral Nutrition Contributes to Plant Disease and Pest Resistance. Recuperado de: http://edis.ifas.ufl.edu
Stover R. H. (2000). Diseases and other banana health problems in tropical Africa. Acta Horticulturae, 540, 311–317.
Torrado-J M., & Castaño-Z J. (2008). Incidencia y severidad de las sigatokas negra (Mycosphaerella fijiensis Morelet) y amarilla (Mycosphaerella musicola Leach et Mulder) del plátano según los estados fenológicos. Agron. Colomb. 26(3), 435-442.
Turner D. W., Fortescue J. A., & Thomas D. S. (2007). Environmental physiology of the bananas (Musa spp.). Braz. J. Plant Physiol., 19(4), 463–484.
Vargas A., Murillo G., Guzmán M., Araya M. & Blanco F. (2008). Efecto de la defoliación a floración sobre el rendimiento del banano (Musa AAA, subgrupo Cavendish) y la severidad de la Sigatoka negra en condiciones semicomerciales. Corbana, 34(61), 39-54.
Violante A. & Caporale A. G. (2015). Biogeochemical processes at soil-root interface. J. soil Sci. Plant Nutr., 15(2), 422-448.
1. Universidad del Magdalena, Santa Marta Colombia. Carrera 32 No. 20-08 Santa Marta, tel 5754217940, saguirre@unimagdalena.edu.co
2. Universidad del Magdalena, Santa Marta Colombia. Carrera 32 No. 20-08 Santa Marta, tel 5754217940, Correo electrónico de contacto: npiraneque@unimagdalena.edu.co
3. Universidad Autónoma de Chiapas. Boulevard Belisario Domínguez km. 1081 sin número Tuxtla Gutiérrez, Chiapas México CP 29050, tel 57 9611250250125, sanirg@yahoo.com