

Vol. 38 (Nº 43) Año 2017. Pág. 1
Alexandre Martins dos SANTOS 1; Fernandes Antonio de ALMEIDA 2; Wéverson Lima FONSECA 3; Maria Lúcia Tiburtino LEITE 4; Francisco Fernandes PEREIRA 5; Rezanio Martins CARVALHO 6
Recibido: 25/04/2017 • Aprobado: 21/05/2017
RESUMO: O trabalho teve como objetivo avaliar o potencial de diferentes concentrações do ácido pirolenhoso no manejo de Meloidogyne incognita, na cultura da alface. O experimento foi realizado em casa de vegetação, na Universidade Federal do Piauí, em Bom Jesus. O delineamento foi inteiramente casualizado, com dez tratamentos e cinco repetições. Após 72 h de inoculação (5.000 ovos/juvenis) por plantas, foram aplicados os tratamentos. Aos 30 dias da inoculação avaliou-se: as características agronômicas das plantas e as de parasitismo dos nematoides. Todas as concentrações foram eficientes, com ação nematostática e nematicidas, porém, com efeito fitotóxico para algumas concentrações. |
ABSTRACT: The work aimed to evaluate the potential of different pyroligneous acid concentrations in management of Meloidogyne incognita on lettuce culture. The experiment was conducted in a greenhouse at the Federal University of Piauí in Bom Jesus. The experimental design was completely randomized, with ten treatments and five replications. After 72 h of inoculation (5,000 eggs/juveniles) for plants were applied treatments. The 30 days of inoculation was evaluated: parasitism characteristics of agronomic plants and nematodes. All concentrations were efficient with nematostatic action and nematicide, however, phytotoxic effect the plants for a few concentrations. |
A alface (Lactuca sativa L.) é uma das hortaliças mais difundida em todo mundo, pela facilidade de adaptação e possibilidade de cultivo sucessivo, com produção garantida o ano todo e rápido retorno de investido (Medeiros et al., 2007).
Entre os principais problemas que inviabilizam o desenvolvimento dessa cultura, estão os nematoides de galhas, a exemplo de Meloidogyne incognita, onde a grande maioria das cultivares explorada são altamente suscetíveis (Charchar & Moita, 1996 & Wilcken et al., 2005).
As plantas quando parasitadas pelo gênero Meloidogyne, apresentam baixo crescimento com sintoma clássico de deficiência mineral, pelo tamanho e volume foliar reduzidos, tornando-as inadequadas para comercialização in natura (Ornat & Sorribas, 2008). Na raiz é possível a visualização de galhas, formadas a partir da hipertrofia e hiperplasia celular, decorrente do processo de parasitismo do patógeno.
Considerando a importância dessa cultura no âmbito socioeconômico e a sua vulnerabilidade aos fitonematoides, vários métodos vem sendo utilizados, a exemplo de extratos vegetais (Fonseca et al., 2017), controle biológico (Sharma & Vivaldi, 2003) e rotação de cultura (Charchar et al., 2007), na tentativa de reduzir o emprego dos defensivos químicos, principal forma de manejo, no entanto, responsável por inúmeros resultados negativos com prejuízo direto ao homem e ao meio ambiente (Dong & Zhang, 2006).
O extrato pirolenhoso (EP), também conhecido como ácido pirolenhoso ou vinagre de madeira, é obtido pela condensação da fumaça formada pela queima da madeira na produção de carvão vegetal (Maekawa, 2002). Trata-se de um líquido de cor amarela a marrom-avermelhada, composto em sua maior parte, por água e mais de 200 compostos orgânicos, dentre os quais, ácido acético, alcoóis, cetonas, fenóis e alguns derivados de lignina (Campos, 2007). Esse produto vem sendo utilizado para diversos fins na agricultura, como “fertilizante orgânico”, aplicado ao solo na cultura do arroz (Tsuzuki et al., 2000), no controle de patógenos de solo, como os nematoides fitoparasitas, com ação nematicida (Serra, et al., 2008), além de apresentar efeito fungicida para diversos fungos patogênicos (Cuadra et al., 2000).
Diante do exposto, objetivou-se avaliar o potencial de diferentes concentrações do ácido pirolenhoso no manejo de nematoides das galhas (M. incognita) na cultura da alface, em condições de casa de vegetação.
O experimento foi conduzido em casa de vegetação e Laboratório de Fitopatologia, no Campus Profa Cinobelina Elvas-CPCE, da Universidade Federal do Piauí, situado no município de Bom Jesus-PI, localizado às coordenadas geográficas 09º04’28‟S, 44º21’31‟W com altitude média de 277 m, precipitação média entre 900 a 1200 mm/ano e temperatura média de 26,5ºC (Viana et al., 2002).
Para avaliação dos tratamentos, o substrato empregado foi constituído por solo-areia-esterco na proporção 3:2:1, respectivamente, esterilizado em autoclave vertical em temperatura de 120 oC e pressão de 1,05 Kgcm2 por duas horas. Em seguida o substrato foi adubado conforme a análise e distribuídos em vasos plásticos com capacidade de 4 dm3. O delineamento experimental foi inteiramente casualizado, com 10 tratamentos correspondentes às concentrações do ácido Pirolenhoso diluído em água (0,0%; 0,5%; 10%; 15%; 20%; 25%; 30%; 35%; 40% e 50%), com cinco repetições.
Empregou-se a cultivar “Repolhuda Todo Ano” (grupo Lisa), pela sua importância econômica e aceitação no mercado, além da alta suscetibilidade aos nematóides das galhas. As mudas foram produzidas em bandejas de poliestireno expandido com substrato comercial. O transplantio ocorreu após a formação de quatro folhas definitivas (27 DAS), onde utilizou-se uma muda por vaso, correspondente a unidade experimental. Para atender as necesidades hídrica das plantas, a irrigação foi realizada diariamente com a quantidade de água reposta, baseada na diferença de peso dos vasos, mantendo a umidade em 60% da capacidade de campo (Monteiro & Frighetto, 2000).
O inóculo foi obtido de população de Meloidogyne incognita de raízes de tomateiro, oriunda no município de Bom Jesus, PI. Para extração dos nematoides das raízes, empregou-se o método de extração proposto por Hussey & Barker (1973), modificado por Bonetti & Ferraz (1981), que consiste em processar o sistema radicular infectado em liquidificador com uma solução de hipoclorito de sódio (NaOCl) a 0,5%, seguido da sequência do processado por um jogo de peneiras de 20 e 500 mesh, para a obtenção da suspensão do inóculo.
As plantas foram inoculadas no sétimo dia de transplantadas, onde cada vaso recebeu uma suspensão (5.000 ovos/juvenis) de nematóides, estimada por mililitro sob microscópio óptico, com auxílio de lâmina de Peter (Southey, 1970). O inóculo foi aplicado com auxílio de uma pipeta, distribuído em três aberturas com profundidade de 3,0 cm, distanciados 2,0 cm do colo das mudas para facilitar o desenvolvimento da ação dos nematoides no solo. Decorrido setenta e duas horas da inoculação, foram realizadas as aplicações com ácido pirolenhoso na superfície de cada vaso.
As avaliações foram realizadas após trinta dias da inoculação dos nematoides, por meio das características agronômicas: diâmetro foliar, altura de planta, comprimento do caule (com uso de paquímetro digital e de régua, respectivamente), número de folhas, peso fresco da parte aérea e peso fresco do sistema radicular (com auxílio de balança analítica); comprimento radicular total (com uso de régua) e volume da raiz (utilizando uma proveta de 1000 ml, considerando um volume fixo de 800 mL, emergindo a raiz e realizando a diferença, obtendo assim o volume final).
Para as características do parasitismo: número de galhas das raízes (empregou-se um contador manual e lupa), massa de ovos em 10g de raízes, onde as raízes foram lavados em água corrente e mergulhadas em solução de fucsina ácida por 10 minutos, para melhor visualização das massas de ovos, de acordo com Silva et al. (1988). Realizou-se ainda, contagem do número de juvenis no solo, a partir de 300 cm3, pelo método de flotação e centrifugação em solução de sacarose, conforme Jenkins (1964), bem como também, a extração dos nematoides nas raízes, pelo método de Coolen & D’herde (1972). A seguir, a população de nematóides nas amostras foi estimada ao microscópio estereoscópio, com auxílio da câmara de contagem de Peters (Southey, 1970).
Para as análises estatísticas, os dados foram transformados em √(x+1), e as médias comparadas pelo teste Scott & Knot (p<0,01) de probabilidade. As análises estatísticas foram realizadas com o auxílio do software SISVAR (Ferreira, 2011).
De acordo com a análise de variância, para as características agronômicas e do parasitismo dos nematoides sobre a cultura da alface, em função das diferentes concentrações do ácido pirolenhoso, todos os tratamentos influenciaram acentuadamente as variáveis, com efeito significativo a (p<0,01) pelo Teste F (Tabela 1). No entanto, os resultados nesse estudo, promoveram efeitos negativos para algumas características agronômicas da alface, com perdas significativas comparado a testemunha, demonstrando efeito fitotóxico, pela inibição no crescimento e desenvolvimento vegetativo da cultura (Tabela 2).
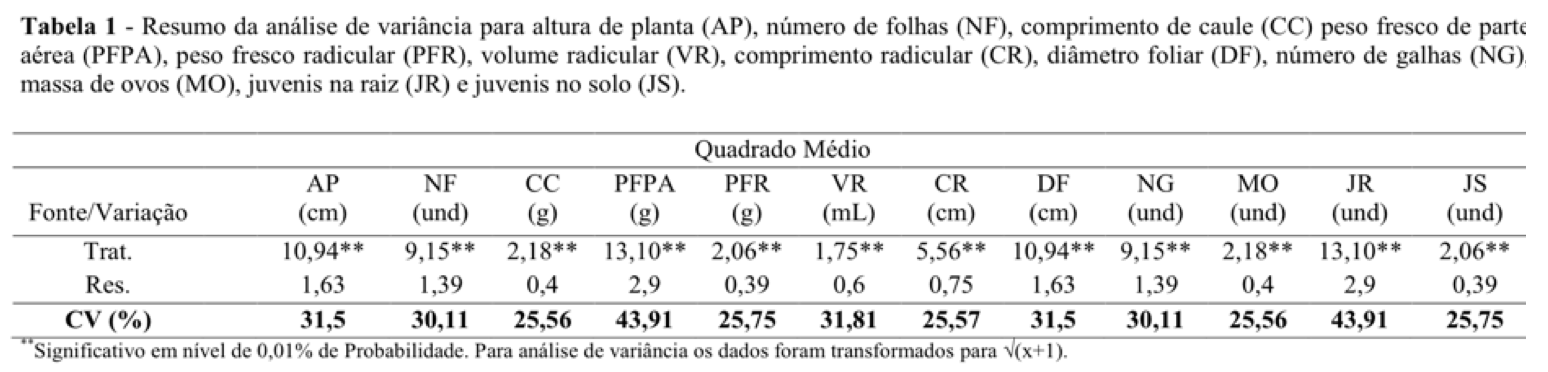

Alguns aspectos atribuídos a esse dano pode está relacionado à cultura empregada, podendo ser potencialmente sensível ao ácido, assim como também, as concentrações aplicadas, que podem inibir o desenvolvimento das plantas quando expostas (Pangnakorn, et al., 2011).
Em relação às características agronômicas, metade das variáveis avaliadas, a exemplo de altura de planta (AP), número de folhas (NF), comprimento do caule (CC) e peso fresco de parte aérea (PFPA), se mostraram mais sensíveis à presença dos compostos contidos no ácido pirolenhoso, inviabilizando ganho vegetativo das plantas. Resultados já observados também por Rochi Filho (2005), para a cultura do milho, com aplicação do ácido pirolenhoso no solo e via foliar sob diferentes doses, sem efeito significativo sobre os fatores de produtividade (diâmetro de colmos, número de fileiras por espiga, número de grão por fileira e peso de grãos).
Nesse sentido, é possível que algumas características químicas do ácido pirolenhoso, como o pH extremamente baixo (2,9) e ácido acético como um dos principais compostos (Zanetti et al., 2004; Steiner et al., 2008), tenham influenciado negativamente sobre alguns nutrientes do solo, neutralizando sua disponibilidade as plantas.
Para as demais variáveis, percebe-se grande variação no comportamento das concentrações utilizadas sobre as características agronômicas da alface, inclusive com perdas significativa em relação à testemunha (Tabela 2). No entanto, algumas variáveis avaliadas, referentes ao sistema radicular, apresentaram ganho significativo, a exemplo de peso fresco da raiz (91,11%); volume radicular (120%); comprimento radicular (76,19%) e a exceção, o diâmetro foliar (110,34%), como seguimento de parte aérea, se mostraram promissoras sob o efeito na menor concentração (5%), diferentemente do que foi observado para a concentração máxima (50%), onde as plantas apresentaram valores de média estatisticamente igual ou abaixo da testemunha.
Esechie et al. (1998), com aplicação do ácido pirolenhoso sem diluição, teveram 60% de mortalidade das plantas de sorgo forrageiro. Entretanto, Gardner et al. (2001), relatam que a ação do ácido pirolenhoso, tem maior efeito positivo na germinação de sementes de plantas, em função das respostas hormonais, pela interação com giberelinas, citocininas, ácido abscísico e etileno das sementes (Van Staden et al., 2000).
Resultado dessa natureza demonstra a importância de se continuar pesquisando, tendo em vista que são poucas as informações científicas do ácido pirolenhoso no Brasil, referente às concentrações e formas de aplicações (via solo e/ou pulverizadas na parte aérea) nas diferentes culturas, o que pode influenciar diferencialmente em cada cultivar e nos diferentes ambientes de cultivo, qual tem sido pouco explorado, pois em determinadas situações e uso, pode-se ter uma resposta variável.
Quanto às características do parasitismo dos nematoides na cultura da alface, sob as diferentes concentrações do ácido pirolenhoso utilizadas nesse trabalho, observa-se efeito significativo na redução das variáveis de M. incognita (Tabela 3). Com relação ao número de galhas (NG), já com a menor concentração de 5% do ácido pirolenhoso, observa-se diminuição acentuada de 68,30% nessa variável, resultados que persistiu para as demais concentrações, não diferindo estatisticamente entre si. Corbani (2008), obteve a mesma eficiência, com redução a diferentes espécies de nematoides (M. javanica e M. incognita), tanto no solo, quanto na formação de galhas nas raízes das plantas.
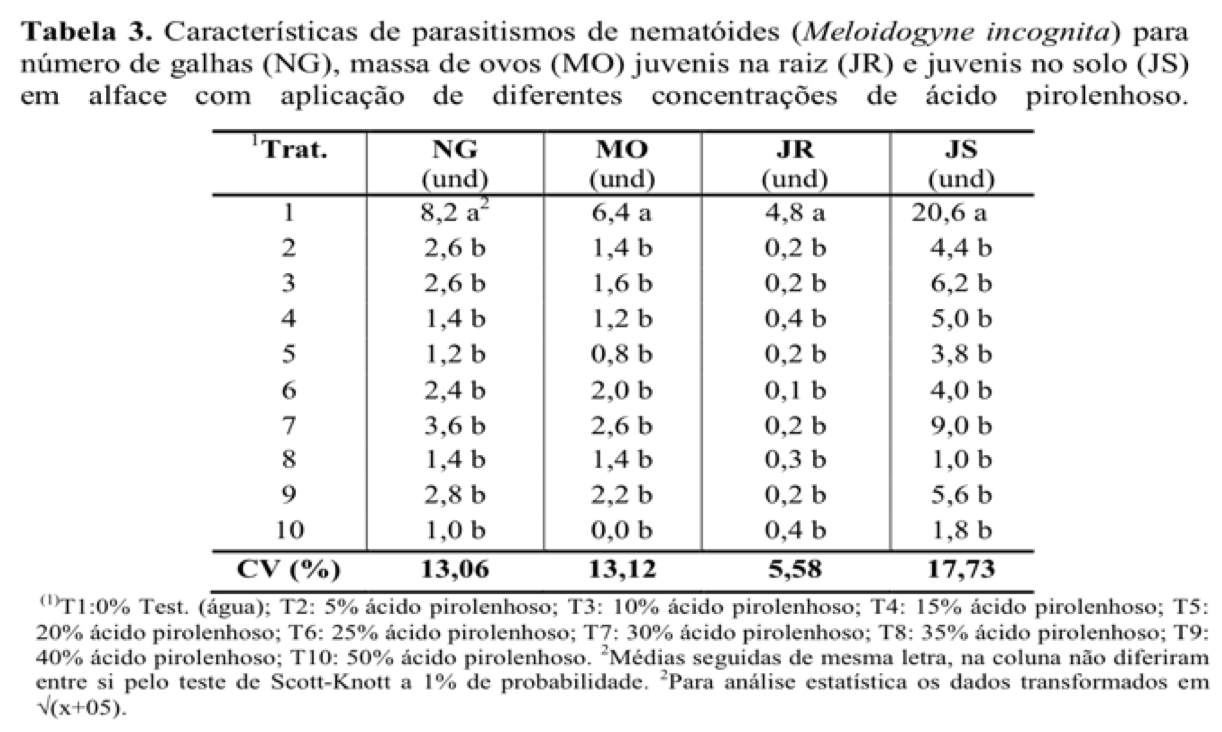
Para a massa de ovos (MO), a eficiência também foi alcançada com a menor concentração, com decréscimo da ordem de 78,13%, com os valores estatisticamente menores que a testemunha. Esses resultados corroboram com Melo et al. (2012), quando obtiveram redução do número de ovos para M. incognita, também com aplicação a 5% de ácido pirolenhoso, na cultura do tomateiro. Contudo, a eficiência do ácido pirolenhoso, está atrelada muitas vezes, a forma de aplicação e as concentrações empregada, para que o efeito ativador ou inibidor do ácido sobre os organismos vivos, venha ocorrer efetivamente (Wei et al., 2010).
Já para a variável juvenis na raiz (JR), todos os tratamentos empregados diferiram estatisticamente da testemunha, com redução acentuada de 95,83% de infecção nas raízes. Esse efeito é possível pela capacidade de exposição de compostos químicos como: cetonas; ésteres; aldeídos; ácidos; metanol; alcatrão solúvel; cadeias fenólicas e água, presentes no ácido pirolenhoso (Campos, 2007), que podem ser absorvidos pelas plantas, e assim, promover efeito nematicida (Nakai et al., 2007).
Os resultados revelam ainda, que a alface não submetida aos tratamentos, se apresentou com alta densidade populacional, comprovando assim, a vulnerabilidade da cultivar quanto à presença da espécie M. incognita (Tabela 3). Dessa forma, a necessidade de um método alternativo para material dessa natureza é de extrema importância, uma vez que a ação dessa praga compromete todo desenvolvimento vegetativo e reprodutivo da planta.
No que se refere ao número de juvenis no solo (JS), observa-se os maiores valores de médias dessa variável, o que demonstra aparentemente que o produto tem uma eficiência moderada quando em contato com as larvas no solo. Mesmo assim, a redução do número de indivíduo foi 78,64% em comparação à testemunha, observado já no primeiro tratamento, que corresponde a menor concentração (5%). Contudo, a redução dos nematoides no solo, não está associada somente ao contato direto de alguns compostos presentes no ácido pirolenhoso, mas a disponibilidade desses, viabilizando as propriedades físicas, químicas e biológicas do solo, potencializando a absorção dos nutrientes pelas plantas e assim, promovendo indução de resistência (Zanetti, 2004).
Assim, a eficiência dos produtos alternativos dessa natureza sobre determinada praga, pode ocorrer também de forma indireta, por meio da indução de resistência a planta. Serra et al. (2008), avaliaram o efeito de indutores naturais sobre a resistência a M. incognita em plantas de alface, entre eles, o ácido pirolenhoso semostrou promissor na redução da população do nematoide. Michereff-Filho et al. (2008), destacam ainda que, o extrato pirolenhoso apresenta a vantagem da seletividade sobre alguns inimigos naturais, com efeito deletérico ou mesmo deterrente a algumas pragas alvo, viabilizando como mais uma alternativa de uso em agricultura orgânica. De acordo com Rossi & Lima (2007), o ácido pirolenhoso tem efeito supressivo também, sobre outras espécies de nematoides, a exemplo de Pratylenchus sp. e Meloidogyne sp. presentes em campos de produção.
Dessa forma, a recomendação do ácido pirolenhoso vem sendo estudada por diversos pesquisadores no mundo, sob diferentes formas de exploração na agricultura, como estimulante da comunidade microbiana do solo (Steiner et al., 2008); no controle de insetos pragas (Alves et al., 2007) e fungos patogênicos de plantas (Chalermsan & Peerapan, 2009); no manejo de nematoides (Doihara, 2005), além dos efeitos na adubação mineral (Schnitzer et al., 2010), através da melhoria das propriedades físicas, químicas e biológicas do solo, favorecendo a assimilação dos nutrientes pela planta.
Nesse sentido, o uso de produto dessa natureza no manejo de fitonematóides, em relação aos produtos sintéticos, pode resultar em benefícios econômicos e ambiental, tendo em vista, por apresentar boa eficiência na redução da população de fitonematóides. No entanto, é necessário ampliar os estudos a nível de campo para observar o comportamento dos compostos químicos do ácido pirolenhoso sobre a comunicade microbiana não alvo e os efeitos sobre os minerais e sua influência na adsorção, na solubilização e a movimentação de nutrientes no perfil do solo.
Todas as concentrações do ácido pirolenhoso promoveram perdas para as características agronômicas de parte aérea na cultura da alface.
O ácido pirolenhoso influenciou na proteção de todas as variáveis do sistema radicular das plantas.
O extrato pirolenhoso proporcionou redução acentuada no parasitismo de Meloidogyne incognita em alface.
A concentração a 0,5% do ácido pirolenhoso, contribuiu com melhor efeito na redução do parasitismo de Meloidogyne incognita.
ALVES, M.; CAZETTA, J. O.; NUNES, M. A.; OIVEIRA, C. A. L.; COOMBI, C. A. (2007). Ação de diferentes preparações de extrato pirolenhoso sobre Brevipalpus phoenicis (GEIJSKES). Revista Brasileira Fruticultura, vol.29, n.2, p.382-385.
BONETTI, J.I; FERRAZ, S. (1981). Modificações do método de Hussey & Barker para extração de ovos de Meloidogyne exigua em raízes de cafeeiro. Fitopatologia Brasileira, vol.6, p.553.
CAMPOS, A.D. (2007). Técnicas para Produção de Extrato Pirolenhoso para Uso Agrícola. Circular Técnica 65. Embrapa Clima Temperado, Pelotas-RS. p.1-4.
CHALERMSAN, Y.; PEERAPAN, S. (2009). Wood vinegar: by-product from rural charcoal kiln and its role in plant protection. As. J. Food Ag-Ind., p.189-195.
CHARCHAR, J. M.; MOITA, A. W. (1996). Reação de cultivares de alface à infecção por misturas populacionais de Meloidogyne incognita raça 1 e Meloidogyne javanica em condições de campo. Horticultura Brasileira, Brasília, DF, vol. 14, n. 2, p. 185-189.
CHARCHAR, J.M.; GONZAGA, V.; VIEIRA, J.V.; OLIVEIRA, V.R.; MOITA, A.W.; ARAGÃO, F.A.S. (2007). Efeito da Rotação de Culturas no Controle de Meloidogyne spp. em Cenoura na Região Norte do Estado de Minas Gerais. Nematologia Brasileira, Vol. 3,n 3, p.
COOLEN, W.A.; D’HERDE, C.J. (1972). A method for the quantitative extraction of nematodes from plant tissue. Ghent: State Agricultural Research Center. 77 p
CORBANI, R.Z. (2008). Estudo do extrato pirolenhoso Biopirol ® no manejo de nematóides em cana-de-açúcar, olerícolas e citros, em diferentes ambientes. Tese (Doutorado em Produção Vegetal) – Faculdade de Ciências Agrárias e Veterinária, Universidade Estadual Paulista, Jaboticabal-SP. 55 p.
CUADRA, R.; CRUZ, X.; PEREIRA, E.; MARTIN, E.; DIAZ, A. (2000). Algunos compuestos naturales con efecto nematicida. Revista de Protección Vegetal, La Habana, v.24, n.15, p.31-37.
DONG, L.Q.; ZHANG, K.Q. (2006). Microbial control of plant-parasitic nematodes: a five-party interaction. Plant Soil, vol. 288, n. 1, p. 31-45.
ESECHIE, H.A.; DHALIWAL, G.S.; ARORA, R.; RANDHAWA, N.S.; DHAWAN, A.K. (1998). Assessment of pyroligneous liquid as a potential organic fertilizer. In: Ecological agriculture and sustainable development, 1997, Chandigarh, India. Proceedings... Chandigarh: Center for Research in Rural and Industrial Development. vol.1, p. 591-595
FERREIRA, D.F. (2011) Sisvar: a computer statistical analysis system. Revista Ciência e Agrotecnologia, Lavras. vol. 35, n. 6, p. 1039-1042.
FONSECA, W.L.; ALMEIDA, F.A. de; LEITE, M.L.T.; RAMBO, A.P.P.; PETTER, F.A.; OLIVEIRA, A.M. de; CARVALHO, R.M.; ALCÂNTARA Neto, F. de; PEREIRA, F.F. (2017). Bioactivity of aqueous extracts of Anadenanthera macrocarpa to Meloidogyne incognita in cotton crop. Australian Journal of Crop Science., vol. 11, n. 02, p.156-161.
GARDNER, M.J.; DALLING, K.J.; LIGHT, M.E.; JÄGER, A.K.; VAN STADEN, J. (2001). Does smoke substitute for red light in the germination of light-sensitive lettuce seeds by affecting gibberellin metabolism? South African Journal of Botany, Pietermaritzburg, v. 67, p. 636–640.
HUSSEY, R.S; BARKER, K.R. (1973). A comparison of methods colleting inocula of Meloidogyne spp. including a new technique. Plant Disease Reporter, vol 57, p.1025-1028.
JENKINS, W.R. (1964). A rapid centrifugal-flotation technique for separating nematodes from soil. Plant Disease Reporter, v.48, p.692-695.
MAEKAWA, K. Curso sobre produção de carvão, extrato pirolenhoso e seu uso na agricultura (APAN – Associação dos produtores de Agricultura natural). 2002. Apostila
MEDEIROS, D.C.; LIMA, B.A.B.; BARBOSA, M.R.; ANJOS, R.S.B.; BORGES, R.D.; CAVALCANTE NETO, J.G.; MARQUES, L.F. (2007). Produção de mudas de alface com biofertilizantes e substratos. Horticultura Brasileira, v. 25, n. 3, p. 433-436.
MELO, T.A. de; SERRA, I.M.R. de S.; SILVA, G.S. da; SOUSA, R.M.S de. (2012) Produtos naturais aplicados para manejo de Meloidogyne incognita em tomateiros. Summa Phytopathol., Botucatu, vol. 38, n. 3, p. 223-227.
MICHEREFF‐FILHO, M.; TORRES, J. B.; ANDRADE, L. N. T.; NUNES, M. U. C. (2008). Effect of some biorational insecticides on Spodoptera eridania in organic cabbage. Pest Management Science, vol. 64, n. 7, p. 761‐767.
MONTEIRO, R.T.R.; FRIGHETTO, R.T.S. (2000). Capacidade de retenção de água do solo. In: FRIGHETTO, R.T.S.; VALARINE, P.S. (Coords.). Indicadores biológicos e bioquímicos da qualidade do solo. Jaguariúna: Embrapa Meio Ambiente. p.37-39.
NAKAI, T.; KARTAL, S.N.; HATA, T.; IMAMURA, Y. (2007). Chemical characterization of pyrolysis liquids of wood-based composites and evaluation of their bio-efficiency. Building and Environment, vol.42, p.1236-1241.
ORNAT, C.; SORRIBAS, F.J. (2008). Integraded management of root-knot nematodes in mediterranean horticultural crops. In: CIANCIO, A.; MUKERJI, K. G. Integrated management and biocontrol of vegetable and grain crops nematodes. Dordrecht: Springer. p. 259-312.
PANGNAKORN, U., KANLAYA, S., KUNTHA, C. (2011). Efficiency of Wood Vinegar and Extracts from Some Medicinal Plants on Insect Control. Advances in Environmental Biology. vol.5, n.2, p.477–482.
RONCHI FILHO, C. A. Aplicação de extrato pirolenhoso e fino de carvão vegetal em milho (Zea mays L.). (2005). Trabalho de Graduação (Graduação em Agronomia). Faculdade de Ciências Agrárias e Veterinárias. Universidade Estadual Paulista. Jaboticabal, 52p.
ROSSI, C. E.; LIMA, C. B. (2007). Controle alternativo de nematóides em cultura orgânica de cana-de-açúcar. Revista Brasileira de Agroecologia, vol. 2, n. 1, p. 1545-1548.
DOIHARA, I. P. (2005). Efeito da aplicação de extrato pirolenhoso, óleo de Nim (Azadirachta indica) e acibenzolar‐s‐metil sobre a interação nematóide‐planta hospedeira. Recife. Dissertação (Mestrado em Fitossanidade) – Universidade Federal Rural de Pernambuco. 75p.
SCHNITZER, J.A.; FARIA, R.T.; VENTURA, M.U.; SORACE, M. (2010). Substratos e extrato pirolenhoso no cultivo de orquídeas brasileiras Cattleya intermedia (John Lindley) e Miltonia clowesii (John Lindley) (Orchidaceae). Acta Scientiarum Agronomy, vol.32, n.1, p.139-143.
SERRA, I.M.R.S., G.S. SILVA, I.C.M. FERREIRA. (2008). Efeito de indutores naturais de resistência sobre Meloidogyne incognita em alface cultivada em sistema orgânico. Tropical Plant Pathology, Brasília, vol. 33, p.112.
SHARMA, R.D.; VIVALDI, L.J. (2003). Controle biológico de nematóide- das - galhas com a bactéria Pasteuria penetrans. Planaltina, DF: Embrapa. Boletim de pesquisa e desenvolvimento, 80p.
SILVA, G.S.; SANTOS, J.M.; FERRAZ, V.S. (1988). Novo método de coloração de ootecas de Meloidogyne sp. Nematologia Brasileira, vo.12, p.6-7.
SOUTHEY, J. F. (1970). Laboratory methods for work with plant and soil nematodes. London: Ministry of Agriculture and Food. 148 p
STEINER, C.; DAS, K. C.; GARCIA, M.; FORSTER, B.; ZECH, W. (2008). Charcoal and smoke extract stimulate the soil microbial community in a highly weathered xanthic Ferralsol. Pedobiologia, vol.51, p.359-366.
TSUZUKI, E.; MORIMITSU, T.; MATSUI, T. (2000). Effect of chemical compounds in pyroligneous acid on root growthin rice plant. Japan Journal Crop Science, Tokyo, vol.66, n.4, p.15-16.
VAN STADEN, J.; BROWN, N.A.C.; JÄGER, A.K.; JOHNSON, T.A. (2000). Smoke as a germination cue. Plant Species Biology, Sapporo, vol. 15, n. 2, p.167-178.
VIANA, T.V.A.; VASCONCELOS, D.V.; AZEVEDO, B.M.; SOUZA, B.F. (2002). Estudo da aptidão agroclimática do Estado do Piauí para o cultivo da aceroleira. Ciência Agronômica, Fortaleza, vol.33, n.2, p.5-12.
WEI, Q.; M.A, X.; DONG, J. (2010). Preparation, chemical constituents and antimicrobial activity of pyroligneous acids from walnut tree branches. J. Anal. Appl. Pyrolysis, vol.87, p.24- 28.
WILCKEN, S. R. S.; GARCIA, M. J. D. M.; SILVA, N. (2005). Resistência de alface do tipo americana a Meloidogyne incognita raça 2. Nematologia Agrícola, Piracicaba, vol. 29, n. 2, p. 267-271.
ZANETTI, M.; CAZETTA, J.O.; JÚNIOR, D.M.; CARVAHO, S.A. (2004). Influência do extrato pirolenhoso na calda de pulverização sobre o teor foliar de nutrientes em limoeiro ‘cravo’. Revista Brasileira Fruticultura, vol.26, n.3, p.529-533.1. Engenheiro Agrônomo – Mestre em Fitotecnia - Universidade Federal do Piauí/UFPI – CEP 64.900-000 – Bom Jesus,PI, Brasil, e-mail: alexgatao.10@hotmail.com
2. Engenheiro Agrônomo – Professor Doutor – Unidade Acadêmica de Ciências Agrárias – Universidade Federal de Campina Grande/UFCG – CEP 58.840-000 – Pombal, PB, Brasil, e-mail: fernandesalmei@gmail.com
3. Engenheiro Agrônomo – Doutorando em Agronomia –Universidade Federal do Ceará/UFC – CEP 60.020-181 – Fortaleza, CE, Brasil, email: weversonufpi@gmail.com
4. Bióloga – Mestranda em Fitotecnia - Universidade Federal do Piauí/UFPI – CEP 64.900-000 – Bom Jesus,PI, Brasil, e-mail: luciatiburtino@gmail.com
5. Engenheiro Agrônomo – Professor Doutor – Universidade Federal do Piauí/UFPI – CEP 64.900-000 – Bom Jesus, PI, Brasil, email: ffpereir@gmail.com
6. Engenheiro Agrônomo – Doutorando em Fitopatologia – Universidade Federal Rural de Pernambuco/UFRPE – CEP 52.171-900 – Recife, PE, Brasil, email: rezanioagronomia@hotmail.com