

Vol. 38 (Nº 41) Año 2017. Pág. 26
Marines Batalha Moreno KIRINUS 1; Pricila Santos da SILVA 2; Caroline Farias BARRETO 3; Roberto Pedroso de OLIVEIRA 4; Marcelo Barbosa MALGARIM 5
Recibido: 06/04/2017 • Aprobado: 04/05/2017
RESUMO: Este estudo objetivou avaliar a redução das podridões e as alterações na qualidade dos tangores 'Ortanique' durante o armazenamento refrigerado, tratados com indutores de resistência na pré-colheita. Os tratamentos realizados foram: testemunha, selênio, silício, acibenzolar-s-metil, metil jasmonato, tiametoxam e imidacloprido. As avaliações realizadas foram coloração, acidez titulável, sólidos solúveis, ácido ascórbico e índice de podridões. Os diferentes indutores proporcionaram reduzir a porcentagem de podridões, mantiveram a coloração e aumentaram a acidez e açucares, demonstrando eficiência na indução de resistência. |
ABSTRACT: The objective of this study was to evaluate the reduction of rot and changes in the quality of 'Ortanique' tangors during the refrigerated storage, treated with pre-harvest resistance inducers. The treatments were: control, selenium, silica, acibenzolar-s-methyl, methyl jasmonate, thiamethoxam and imidacloprid. The evaluations were coloration, titratable acidity, soluble solids, ascorbic acid and rot index. The different inducers allowed to reduce the incidence of rot, maintained the coloration and increased acidity and sugars, demonstrating efficiency in the induction of resistance system. |
A produção de citros no Brasil ocupa a terceira posição no ranking mundial, alcançando 30% da produção com aproximadamente 15 mil toneladas. No entanto, sua produtividade é baixa se comparada a outros países produtores (FAO, 2016). Isso se deve a diferentes fatores, como doenças sistêmicas que atacam os pomares, entre elas greening (Candidatus spp.), morte súbita (MSC), cancro cítrico (Xanthomonas citri) e mancha preta (Guignardia citricarpa), e também, existem as doenças que ocorrem após a colheita, como os bolores (Penicillium spp.) (Theodoro & Koller, 2013).
Uma das alternativas para a redução dessas doenças na cultura consiste na utilização de genótipos tolerantes ou resistentes, advindos dos programas de melhoramento genético. No entanto, com a indisponibilidade de cultivares com tais parâmetros, este método torna-se inviável. Outra alternativa prevê o emprego de tecnologias, como a indução da resistência sistêmica adquirida (RSA) que é um mecanismo de defesa natural das plantas o qual, após ser induzido, pode conferir longa duração na proteção contra amplo espectro de microrganismos (Van Loon et al., 2006). Plantas sensíveis podem adquirir maior capacidade de defesa contra ataques subsequentes de patógenos, a partir de infecção primária, limitada a um patógeno ou a partir do tratamento com indutores químicos de resistência (Pinto, 2011). Com a utilização desses métodos deseja-se a redução de doenças nos pomares, e principalmente na pós-colheita, minimizando-se os problemas com o ambiente causados pela utilização repetitiva e abusiva de agrotóxicos.
Algumas substâncias são promotoras da indução de RSA através de um sinal molecular como selênio, silício, acibenzolar-S-metil, metil-jasmonato e neocotinoides. O selênio é um microelemento que após ser absorvido pela planta pode permanecer na forma inorgânica, volátil ou em formas reduzidas acopladas, é uma molécula com elevada capacidade antioxidante e de indução do sistema de defesa da planta (Becvort, 2011). O silício também desempenha função de defesa, combinando atributos físicos e químicos, tais como a lignificação da parede celular, indução de várias proteínas de defesa (French-Monar, 2010; Schultz, 2012), conforme verificado no abacate (Tesfay et al., 2011), algodoeiro (Oliveira et al., 2012), café (Asmar et al., 2013) e tomate (Andrade et al., 2013). O acibenzolar-S-metil é um análogo funcional do ácido salicílico, capaz de ativar defesas da planta, tais como proteínas relacionadas à patogênese, sendo utilizado em maçãs (Quaglia et al., 2011) e citros (Graham & Myers, 2011). O metil-jasmonato interfere nos processos fisiológicos e bioquímicos, demonstrando resultados promissores na indução de resistência, através da biossíntese de metabólitos secundários (Zhou & Memelink, 2016) e apresentou resultados promissores na nêspera (Cao et al., 2012; Cai et al., 2011), romã (Sayyari et al., 2011) e banana (Zhao et al., 2012). Recentemente, substâncias como neocotinoides, imidacloprido e tiametoxam, têm sido utilizadas com sucesso na indução de resistência em citros (Graham & Myers, 2011).
A ocorrência de doenças nos pomares é um dos principais fatores responsáveis por elevadas perdas na produção em todas as regiões do país, principalmente na pós-colheita (Moretto et al., 2014). Além disso, há preocupação em relação ao consumo de frutas seguras, devido ao uso impróprio de produtos químicos na pré e pós-colheita (Colnot & Dekant, 2017). Deste modo, o objetivo do trabalho foi avaliar a redução de podridões e a qualidade pós-colheita do tangoreiro 'Ortanique' durante o armazenamento refrigerado, após a aplicação de indutores de resistência em pré-colheita.
O experimento para aplicação dos indutores de resistência foi conduzido a campo, na safra de 2016, em pomar comercial (31º40'47"S, 52º26'24"O e altitude de 60 metros) localizado em Monte Bonito, 9º distrito do município de Pelotas, Rio Grande do Sul (RS), Brasil. O local possui solo moderadamente profundo, com textura média no horizonte A e argilosa no B, classificado como Argissolo Vermelho Amarelo (Embrapa, 2006). O clima da região é do tipo "Cfa", ou seja, temperado úmido com verões quentes (Köppen e Geiger, 1928), com precipitação média anual de 1.582 mm, temperatura média anual de 18,4°C e com umidade relativa média anual de 78,8% (INMET, 2016). No pomar experimental foi aplicado o fungicida Nativo (trifloxixtrobina e tebuconazol) três aplicações espaçadas de 30 dias, sendo a primeira aplicção no estádio fenológico de frutinhos recém-formados, e também realizou-se a aplicação da calda bordalesa (sulfato de cobre e cal virgem) com seis aplicações espaçadas de 45 dias, sendo a partir da floração com término de 60 dias antes da colheita.
O delineamento experimental a campo para a aplicação dos indutores de resistência foi em blocos completamente casualizados, com cinco repetições, em esquema unifatorial. O fator de tratamento foi composto pelos indutores de resistência [sem indutor (testemunha, água), selênio (Se, 10mg.L-1), silício (Si, 400mg.L-1), acibenzolar-s-metil (ASM, 100mg.L-1), metil jasmonato (MeJa, 10mg.L-1), tiametoxam (TMT, 2000mg.L-1) e imidacloprido (IMI, 714mg.L-1)].
A aplicação dos indutores de resistência ocorreu com intervalo de aplicação de 15 dias, totalizando três aplicações no pomar, com 45, 30 e 15 dias antes da colheita, coma dosagem total em cada aplicação. As concentrações dos indutores de resistência foram estabelicidas através de testes prelimilares em tangor ‘Murcott’ e tangerina ‘Oktisu’, em uma área experimental da Embrapa, e com base na literatura. Os produtos Si, ASM e MeJa foram aplicados através de aspersão, com pulverizador costal (Guarani®), com bico tipo leque e tamanho de gota fina (101-200µ), em toda a copa da planta, evitando o escorrimento. Para os indutores Se, TMT e IMI preparou-se uma calda de cada produto, que foram aplicadas no solo, ao redor da copa da planta. Em todos os tratamentos adicionou-se 0,1% de espalhante adesivo não iônico Silwet L-77®.
Os frutos foram coletados aleatoriamente na copa da planta nos quatros quadrantes, quando atingiram a maturação comercial ideal, colocados em caixas plásticas limpas e desinfetadas, transportadas ao Laboratório de Fisiologia e Tecnologia Pós-Colheita de Frutas, do Departamento de Fitotecnia da Universidade Federal de Pelotas (UFPel), onde passaram por pré-seleção para padronização, retirando-se os frutos danificados e posteriormente foram submetidos ao pré-resfriamento (15±2ºC) por 24 horas.
No laboratório, o delineamento utilizado foi o mesmo estabelecido a campo, porém em esquema bifatorial, com quatro repetições e 20 frutos por repetição. O fator A foi composto pelos mesmos indutores de resistência descritos anteriormente e o fator B, pelo período de armazenamento (zero, 15, 30, 45 e 60 dias). O armazenamento foi realizado em câmara fria com temperatura de 5±1ºC e umidade relativa de 90±5%, posteriormente foi simulado a vida de prateleira (7 dias com temperatura de 22±2ºC).
As análises realizadas foram índice de podridões, perda de massa fresca, coloração (L* e hue), acidez titulável (AT), sólidos solúveis (SS) e ácido ascórbico. O índice de podridões foi estabelecido pelo percentual (%) de frutos atacados por patógenos através de verificação visual dos frutos, onde frutos com lesão maior ou igual a 5 mm foram considerados como podres. A perda de massa fresca dos frutos foi obtida através de balança semianalítica pela diferença entre a massa inicial e final do período de armazenamento refrigerado dos frutos, sendo os valores expressos em percentagem (%). A coloração da polpa foi mensurada com colorímetro Minolta CR-300, utilizando-se o sistema de leitura, aprovado pela Commission Internationale de I’Eclairage (CIE), obtendo-se L*, a luminosidade dos frutos e o matiz ou tonalidade cromática representada pelo ângulo hue (Minolta, 1994). A acidez titulável (AT) foi realizada através de titulação utilizando 10 mL de polpa triturada dos frutos, adicionada a 90 mL de água destilada. A titulação da amostra foi feita com o auxílio de bureta, contendo solução de hidróxido de sódio (NaOH) a 0,1 N, até atingir o ponto de viragem (pH 8,1). A acidez titulável foi expressa em gramas de ácido cítrico por 100g de amostra (Instituto Adolfo Lutz, 2008). O teor de sólidos solúveis foi quantificado com refratômetro digital (ATAGO, modelo PAL-1) e o resultado foi expresso em ºBrix (Instituto Adolfo Lutz, 2008).
O teor de ácido ascórbico foi quantificado através do método oficial da AOAC (2005) pela titulação oxidativa com 2,6-Diclorofenol Indofenol (DCFI), com o ponto da titulação sendo detectado pelo aparecimento da coloração rosada no titulado e o resultado foi expresso em mg de ácido ascórbico por 100g da amostra (Jacobs, 1958; Leme & Malavolta, 1950).
Os dados foram analisados quanto à normalidade pelo teste de Shapiro-Wilk e à homocedasticidade pelo teste de Hartley. Posteriormente, foram submetidos à análise de variância (p≤0,05). Em caso de significância, os efeitos dos indutores foram analisados pelo teste de Tukey (p≤0,05) e períodos de armazenamento por modelos de regressão (p£0,05).
O índice de podridões dos frutos armazenados demonstrado na Figura 1, para todos os períodos estudados, os indutores diferiram significativamente da testemunha, principalmente aos 15 +7 dias onde somente a testemunha apresentou podridões (4,4%). Já aos 30 +7 dias de armazenamento os tangores tratados com os indutores de resistência apresentaram redução do percentual de podridões o Se (4,4%) e a Si (2,2%), e por não apresentarem podridões o ASM, MeJa, TMT e IMI (0%), comparados com testemunha (11,1%).
Nos 45 +7 dias a testemunha (17,7%) apresentou a maior incidência de podridões que os tangores tratados com Se (6,6%), Si (8,8%), ASM (6,6%), MeJa (2,2%), TMT (0%) e IMI (2,2%). Ao compararmos com os períodos de armazenamento observou-se um aumento da incidência de podridões ao longo do período do armazenamento nos tangores ‘Ortanique’ não inoculados. Aos 60 +7 dias a testemunha apresentou 35,5% de podridões, superior aos indutores testados, sendo eles o Se com 6,6%, a Si com 19,9%, o ASM com 8,8%, o MeJa com 2,2%, o TMT com 4,4% e o IMI com 6,6%, demonstrando assim a importância da utilização dos mesmos para reduzir as perdas na pós-colheita. Já em tangoreiro ‘Murcott’ para o controle do bolor verde inoculado (Penicillium digitatum) resultou em 47% dos frutos sadios, o que aumentou para 67% quando combinados com o fungicida imazalil a 0,5 mL.L-1 (Moretto et al., 2014). Ao avaliarmos o índice de podridões dos frutos, ocorreu interação entre os indutores e os períodos de armazenamento. O indutor Si não diferiu da testemunha, com valores médios de 7,22 e 15,0 de percentagem de frutos atacados, respectivamente.
A perda de massa dos frutos submetidos aos indutores de resistência obteve uma redução dos seus índices (Figura 1), demonstrando a importância de serem tratados, quando comparados a testemunha. Durante o período de armazenamento dos frutos os indutores Se, ASM e MeJa obtiveram uma menor perda de massa ao final da acondicionamento em câmara fria (≤15%). A perda de massa ao longo do armazenamento é resultado da diminuição do teor de água, que pode ser intensificada devido às alterações fisiológicas nos processos de transpiração e respiração (Prusky, 2011).
Os frutos tratados com o indutor IMI obtiveram a maior perda de massa fresca, juntamente com a testemunha, atingindo valores próximos de 20% ao final do período de armazenamento estudado. Estudos realizados por Bassan et a. (2016) em lima ácida ‘Tahiti’ demonstraram que os frutos ao serem manipulados e comercializados aumentaram a perda de massa fresca. Com isso, devem-se obter alternativas para minimizar estas perdas, como no caso, do acondicionamento pós-colheita de etileno como uma ferramenta de reduzir as perdas de massa de laranjas (Lafuente et al., 2014). Pode-se relacionar quanto menor a perda de massa fresca menor é a incidência de podridões, demonstrando a atuação dos indutores no metabolismo dos tangores, estabilizando assim a respiração e a transpiração dos tecidos (Imtiaz et al., 2016).
Os valores de L*, que indicam a luminosidade (Figura 2), os indutores que apresentaram, no último período de armazenamento, a coloração mais clara foram o MeJa (61,1), seguido pelos indutores Si (58,2), ASM (58,2), TMT (58,6) e IMI (59,0). O MeJa apresentou alto valor de L*, pois desempenha um papel de acumulação de determinadas proteínas relacionadas com patogênese, e aumentam a tolerância ao frio em limão (Citrus limon) mantendo os padrões de qualidade dos frutos armazenados (Siboza et al., 2014). Com o passar do tempo de armazenamento refrigerado dos frutos (Figura 1), após serem submetidos a simulação de vida de prateleira observou-se um crescente escurecimento (valor de L* e Hue) na testemunha, ASM e TMT, fator este prejudicial para a comercialização, por depreciar o produto.
Ao realizar a comparação entre os períodos, através da fórmula da regressão dos indutores (Figura 2), quando os frutos foram retirados do armazenamento refrigerado constatou-se acréscimos, para o indutor Se, em média de 45,77, MeJa de 0,27 e TMT de 0,50 para coloração em L* quando foram comparadas ao tempo inicial. Já testemunha, Si, ASM e IMI obtiveram decréscimos da luminosidade dos frutos com valores médios respectivamente de -3,05, -1,49, -0,91 e -0,52, decréscimos estes ocasionados pelo amadurecimento e queda da qualidade ao longo do armazenamento dos frutos.
Ao longo do período de armazenamento os frutos perdem a pigmentação verde da casca para o aparecimento da cor amarela típica do amadurecimento, em regiões de clima temperado a cor verde, em citros, é perdida naturalmente pela redução da temperatura no pomar (Brotons et al., 2013).
Os valores de ângulo Hue (hº) não apresentaram diferença significativa entre os indutores até 45 + 7 dias de armazenamento. Observou-se que o tratamento ASM manteve melhor as características de qualidade ao longo do período de armazenamento, mantendo o ângulo hue para 45+7 dias de 62,5 e para 60+7 dias de 63,9 (Figura 2). O indutor Si apresentou melhores resultados até 45 + 7 dias (63,6), no entanto aos 60 +7 dias foi o indutor MeJa (63,9), os indutores que não se diferenciaram da testemunha (62,0), foram o selênio (61,5) e silício (62,50). Estas variações ao longo do período de armazenamento para cada indutor ocorrem devido a atuação destas substâncias no metabolismo dos frutos, alterando e interferindo nas rotas metabólicas (Passos & Reis, 2013).
Ao realizar a comparação entre os períodos utilizando a fórmula de regressão (Figura 2), quando os frutos foram retirados do armazenamento refrigerado obtiveram acréscimos para o indutor Si com valor médio de 1,85 para ângulo Hue quando foram comparadas ao tempo inicial, sendo estes benéficos para a manutenção da tonalidade dos frutos. Já os demais tratamentos apresentaram decréscimos com valores médios de -4,54 para testemunha, -6,60 para Se, -2,35 para ASM, -2,85 para MeJa, -2,32 para TMT e -1,82 para IMI . Ao estudar o tangoreiro ‘Ortanique’ com a aplicação de cera de carnaúba os autores Machado et al. (2012) identificaram um incremento nos valores da tonalidade cromática (ângulo hue) dos frutos com o tempo de armazenamento.
Ao analisar os dados de acidez titulável dos frutos (Figura 3), observou-se que, nos indutores de resistência utilizados até os 30 +7 dias, não houve diferença significativa. Ao longo do período de armazenamento dos frutos observa-se acréscimo da acidez dos frutos a partir de 30 +7 dias para a testemunha (1,91% para 2,06%), e também variações da acidez titulável entre os indutores. Aos 45 + 7 dias de armazenamento diferiram da testemunha (1,91%) os indutores Se (1,54%), Si (1,44%) e IMI (1,51%), com valores inferiores de acidez, já aos 60 + 7 dias apenas os indutores Se (1,54%) e Si (1,51%) diferiram da mesma. Os valores de ácido cítrico foram superiores aos encontrados pelos autores Cruz et al. (2009), ao utilizarem tangerinas 'Ponkan' apresentaram valores médios de 0,96 % de ácido cítrico por 100g da amostra, no entanto Rosa et al. (2012), ao estudar poda e raleio com tangerinas 'Montenegrina', encontrou valores médios de 1,49 %.
Ao utilizar a fórmula da regressão com os períodos avaliados observa-se que, os frutos retirados do armazenamento refrigerado, apresentaram acréscimos nos valores médios de acidez, salientando-se os tratamentos com Se de 11,67, TMT de 1,71 e testemunha de 4,12, bem como os indutores Si de 1,78 e MeJa de 10,71, apresentando frutos mais ácidos. E de decréscimo para os indutores ASM de -1,46 e IMI de -7,29, frutos menos ácidos. Os componentes secundários dos frutos podem contribuir com o aumento da acidez e da adstringência, mas, no geral, o teor de ácidos orgânicos diminui com a maturação dos frutos, em decorrência do seu uso na conversão de açúcares como substrato no processo respiratório (Chitarra; Chitarra, 2005).
Com relação aos teores de sólidos solúveis dos frutos de tangoreiro observados na Figura 3, não ocorreu diferença significativa aos 0, 15 e 60 +7 dias de armazenamento, no entanto ao longo do período de armazenamento ocorreram variações significativas. Com 30 +7 dias a Si (12,6 ºBrix), e nos 45 +7 dias os indutores Se (12,6 ºBrix), Si (12,8 ºBrix), MeJa (12,7 ºBrix) e TMT (13,3 ºBrix) diferiram significativamente da testemunha (15,5 ºBrix), com teor de açucares menores. Os valores apresentados são similares aos encontrados no estudo de Simón-Grao et al. (2014), ao caracterizar onze cultivares de tangerinas comerciais na Espanha, entre elas o tangoreiro 'Ortanique'.
O indutor TMT e a testemunha apresentaram um comportamento semelhante de acréscimo ao longo dos períodos testados de armazenamento, através do comportamento linear (Figura 3). Este aumento significativo dos açucares advêm do metabolismo dos frutos, possivelmente por causa da perda do vapor d'água e do processo respiratório (Chitarra & Chitarra, 2005).
Ao realizar a comparação entre os períodos através da fórmula de regressão, quando os frutos foram retirados do armazenamento refrigerado, os sólidos solúveis apresentaram acréscimos em média para a testemunha com 5,45, Se de 16,55, Si de 1,66, ASM de 3,23 e IMI de 2,19, os indutores MeJa e TMT, os quais também apresentaram acréscimos positivos dos açucares ao longo do armazenamento, na ordem de 3,36 e 2,55, respectivamente.
Quanto ao teor de ácido ascórbico na Figura 3, para os períodos 0 e 15 +7, os indutores não apresentaram diferença significativa da testemunha (26,6 e 25,8 mg 100ml-1), embora apresentem menores teores de vitamina C, como o indutor Se (22,4 e 21,0 mg 100ml-1). No período de 30 +7, o Se apresentou menor quantidade de ácido ascórbico (22,2 mg 100ml-1), já com 45 +7 foram os indutores Si (19,3 mg 100ml-1), o ASM (22,5 mg 100ml-1), o MeJa (24,0 mg 100ml-1) e a TMT (23,5 mg 100ml-1). No último período de avaliação, os indutores MeJa (22,5 mg 100ml-1) e TMT (22,30 mg 100ml-1) apresentaram valores superiores de ácido ascórbico, diferindo da testemunha (19,4 mg 100ml-1), seguidos dos indutores Se (21,5 mg 100ml-1), IMI (21,0 mg 100ml-1) e ASM (20,20 mg 100ml-1) demonstraram teores superiores, porém não diferindo significativamente da testemunha.
Ao realizar a comparação entre os períodos e as fórmulas da regressão, quando os frutos foram retirados do armazenamento refrigerado, obtiveram-se acréscimos com valor em média de 61,30 para Se e 21,82 para Si, quando comparadas índices de ácido ascórbico, ao tempo inicial. A testemunha obteve decréscimo em média de -13,64, já os indutores ASM com -5,55, MeJa com -4,14, TMT com -2,45 e IMI com -27,70. Em frutos de laranjeira ‘Pera Bianchi’ armazenados sob refrigeração foi possível observar aumento nos teores de ácido ascórbico de 48,89 (mg 100ml-1) aos 15 dias para 56,76 (mg 100ml-1) aos 45 dias de armazenamento (Rosa et al., 2016).
A utilização dos indutores mantém a qualidade dos frutos do tangoreiro ‘Ortanique’ armazenados sob refrigeração, reduzindo a incidência de doenças. Os indutores que mantiveram a qualidade e reduziram as podridões são metil-jasmonato, tiametoxam e imidacloprido.
Andrade, C.C.L.; Resende, R.S.; Rodrigues, F.A.; Ferraz, H.G.M.; Moreira, W.R.; Oliveira, J. R.; Mariano, R. L. R. 2013. Silicon reduces bacterial speck developmento on tomato leaves. Tropical Plant Pathology (Viçosa) 38:436-442.
AOAC. Association of Official Analysis Chemists. Official methods of analysis (2005) 18th Edition Gaitherburg: Published by AOAC International, 18th, 326p.
Asmar, A.S.; Pasqual, M.; Araujo, A.G.; Silva, R.A.L.; Rodrigues, F.A.; Pio, L.A.S. 2013. Características morfofisiológicas de bananeiras ‘Grande Naine’ aclimatizadas em resposta a utilização de silício in vitro. Ciências Agrárias (Londrina) 34(1):73-82.
Azevedo; C.L.L.; Silva, J.A.A.; Carvalho, J.E.B. 2010. Segunda Versão de Normas Técnicas Específicas (NTE) da Produção Integrada de Citros no Brasil. Embrapa Mandioca e Fruticultura, Documento 192, 19p.
Bassan, M.M.; Mourão Filho, F.A.A.; Alves, R.F.; Bezerra, D.F.; Couto, H.T.Z.; Jacomino, A.P. 2016. Postharvest packing processo f ‘Tahiti’ acid lime affects their quality and conservation. Ciência Rural (Santa Maria) 46 (10), 184-190.
Becvort, A.A.A. 2011 Acumulación de selenio en tomate y su efecto en el crecimiento, productividad y antioxidante del fruto. Maestría en Ciencias en Horticultura, UAAAN. Saltillo, Coahuila, México. pp. 25.
Brotons, J.M.; Manera, J.; Conesa, A. Porras, I. 2013. A fuzzy aproach to the loss of grreen colour in lemon (Citrus lemon L. Burm. F.) rind during ripening. Computers and Electronics in Agriculture (Atenas) 98:222-232.
Cai, Y.; Cao, S.; Yang, Z.; Zheng, Y. 2011. MeJA regulates enzymes involved in ascorbic acid and glutathione metabolism and improves chilling tolerance in loquat fruit. Postharvest Biology Technology (Leuven) 59:324-326.
Cao, S.; Cai, Z.; Yang, Z.; Zheng, Y. (2012). MeJA induces chilling tolerance in loquat fruit by regulating proline and y-aminobutyric acid contents. Food Chemistry (Washington) 133:1466-1470.
Chitarra, M.I.F.; Chitarra, A.B. (2005). Pós-colheita de frutos e hortaliças: fisiologia e manuseio. 2. ed. rev. e ampl. Lavras: UFLA, 785p.
Colnot, T.; Dekant, W. 2017. Approaches for grouping of pesticides into cumulative assessment groups for risk assessment of pesticide residues in food. Regulatory Toxicology and pharmacology (Michigan) 83:89-99.
Cruz, M.C.M.; Ramos, J.D.; Lima, L.C.O.; Moreira, R.A.; Ramos, O.S. 2009. Quality of 'Ponkan' mandarin fruits submitted to chemical thinning. Revista Brasileira de Fruticultura (Jaboticabal) 31(1):127-134.
Cruz, M.C.M.; Ramos, J.D.; Lima, L.C.O.; Moreira, R.A.; Ramos, O.S. 2009. Quality of 'Ponkan' mandarin fruits submitted to chemical thinning. Revista Brasileira de Fruticultura (Jaboticabal) 31(1):127-134.
Embrapa (2006) Centro Nacional de Pesquisa de Solos. Sistema Brasileiro de Classificação dos Solos. 2. ed. Rio de Janeiro: Embrapa Solos, 2006. 306 p.
FAO. Faostat: Production crops. Disponível em <http://faostat.fao.org/site/567/DesktopDefault .aspx?PageID=567#ancor> Acesso em: 10 de julho 2016.
French-Monar, R.D.; Rodrigues, F.A.; Kordorfer, G.H. Datnoff, L.E. (2010) Silicon suppresses Phytophthora blight development on bell pepper. Journal of Phytopathology (Baguio) 158(7-8):554-560.
Graham, J.H.; Myers, M.E. 2011. Soil Application of SAR Inducers Imidacloprid, Thiamethoxam, and Acibenzolar-S-Methyl for Citrus Canker Control in Young Grapefruit Trees. Plant Disease (New York) 95(6):720-729.
INMET. Instituto Nacional de Meteorologia. 2016. Disponível em: < http://www.inmet.gov.br/portal/index.php?r=bdmep/bdmep>. Acesso em: 12 dez. 2016.
Instituto Adolfo Lutz (2008) – Métodos físico-químicos para análise de alimentos. 4. ed. São Paulo: Instituto Adolfo Lutz. v. 1, 1020 p.
Jacobs, M.B. (1958) The chemical analysis of foods and food products. New York: Van Nostrand, 979 p.
Köppen, W.; Geiger, R. (1928) Klimate der Erde. Gotha: Verlag Justus Perthes. Wall-map 150cmx200cm.
Lafuente, M.T.; Alférez, F.; Romero, P. 2014 Pohtharvest ethylene conditioning as a tool to reduce quality loss of stored mature sweet oranges. Postharvest Biology and Technology, (Leuven) 94:104-111.
Leme Junior J.; Malavolta, E. (1950) Determinação fotométrica de ácido ascórbico. Anais da ESALQ 7:115-129.
Machado, F.L.C.; Costa, J.M.C.; Batista, E.M. (2012) Application of carnaúba-based wax maintains postharvest quality of ‘Ortanique’ tangor. Food Science and Technology (Melbourne) 32(2):261-266.
Minolta (1994) Precise color communication: color control from feeling to instrumentation. Brasil: MINOLTA Co. Ltda. 49p.
Moretto. C.; Cervantes, A.L.L.; Filho, A.B.; Kupper, K.C. (2014) Integrated controlo f Green mold to reduce chemical treatment in post-harvest citrus fruits. Scientia Horticulturae (Amsterdam) 165:433-438.
Oliveira, J.C.; Alburquerque, G.M.R.; Mariano, R.L.R.; Gondim, D.M.F.; Oliveira, J.T.A.; Souza, E.B. (2012) Reduction of the severity of angular leaf spot of cotton mediated by silicon. Journal Plant Pathology (Foster) 94:297-304.
Passos, F.R.; Reis, M.R. (2013) Resíduos de Agrotóxicos em Alimentos de Origem Vegetal: Revisão. Revista de Ecotoxicologia e Meio Ambiente (Curitiba) 23:49-58.
Pinto, M.D.S.T.; Ribeiro, J.M.; Oliveira, E.A.G. (2011) O estudo de genes e proteínas de defesa em plantas. Revista Brasileira de Biociências (Porto Alegre) 9(2):241-248.
Prusky, D. 2011. Reduction of the incidence of postharvest quality losses, and future prospects. Food Security, (Oxford), 3 (4), 463-474.
Quaglia, M.; Ederli, L.; Pasqualini, S.; Zazzerini, A. (2011) Biological control agentes and chemicas induceres of resistance for postharvest control of Penicillium expansum Link. on apple fruit. Postharvest Biology and Technology (Leuven) 59(3):307-315.
Rosa, C.I.L.F.; Clemente, E.; Oliveira, D.M.; Todisco, K.M.; Costa, J.M.C. (2016) Effects of 1-MCP on the post-harvest quality of the Orange cv. Pera stored under refrigeration. Revista Ciência Agronômica (Fortaleza) 47(4):624-632.
Rosa, R.D.; Nova, G.A.; Piva, A.L.; Mezzalira, E.J.; Paulus, D. (2012) Poda e raleio manual de tangerineira (Citrus deliciosa Tenore) cv. Montenegrina no Sudoeste do Paraná. Revista Ceres (Viçosa) 59(2):254-261.
Sayyari, M.; Babalar, M.; Kalantari, S.; Martínes-Romero, D.; Guillén. F.; Serrano, M.; Valero, D. (2011) Vapour treatments with methyl salicylate or methyl jasmonate alleviated chilling injury and enhanced antioxidant potential during postharvest storage of pomegranates. Food Chemistry (Baltimore)124:964-970.
Schultz, B.; Bora, K.C.; Nogueira, A.C.; Auer, C.G. (2012) Uso do silicato de potássio no controle de oídio em mudas de Eucalyptus benthamii. Pesquisa Florestal Brasileira (Colombo) 32(69):93-99.
Siboza, X,I,; Bertling, I.; Odindo, A.O. (2014) Salicylic acid and methyl jasmonate improve chilling tolerance in cold-stored lemon fruit (Citrus limon). Journal of Plant Physiology (Campinas) 171(18):1722-1731.
Simón-Grao, S.; Gimeno, V.; Simón, I.; Lidón, V.; Nieves, M.; Balal, R.M.; Carbonell-Barrachina, A.A.; Manera, F.J.; Hernández, F.C.A.; García-Sánchez, F. (2014) Fruit quality characterization of eleven commercial mandarin cultivars in Spain. Scientia horticulturae (Amsterdam) 165:274-280.
Tesfay, S.Z.; Bertling, I.; Bower, J.P. (2011) Effects of postharvest potassium silicate application on phenolics and other anti-oxidant systems aligned to avocado fruit quality. Postharvest Biology and Technology (Leuven) 60(2):92-99.
Theodoro, G.F.; Koller, O.L. (2013) Descrição e manejo integrado das doenças (6):175-235. In: Koller OL (2013) Citricultura Catarinense, Epagri 319p.
Van-Loon LC; Rep M, Pieterse CMJ (2006) Significance of inducible defense-related proteins in infected plants. Annual Review of Phytopathology (Townsville) 44:135-162.
Zhao, M.L.; Wang, J.N.; Shan, W.; Fan, J.G.; Kuang, J.F.; Wu, K.Q.; Li, X.P.; Chen, W.X.; He, F.Y.; Chen, J.Y.; Lu, W.J. (2012) Induction of jasmonate signaling regulators Ma MyC2s and their physical interactions with Mal CE1 in methyl jasmonate-induced chilling tolerance in banana friut. Plant, Cell & Environment (Lens) 31:1365-3040.
Zhou, M.; Memelink, J. (2016) Jasmonate responsive transcription factors regulating plant secondary metabolism. Biotechnology Advances (Toronto) 34(4):441-449.
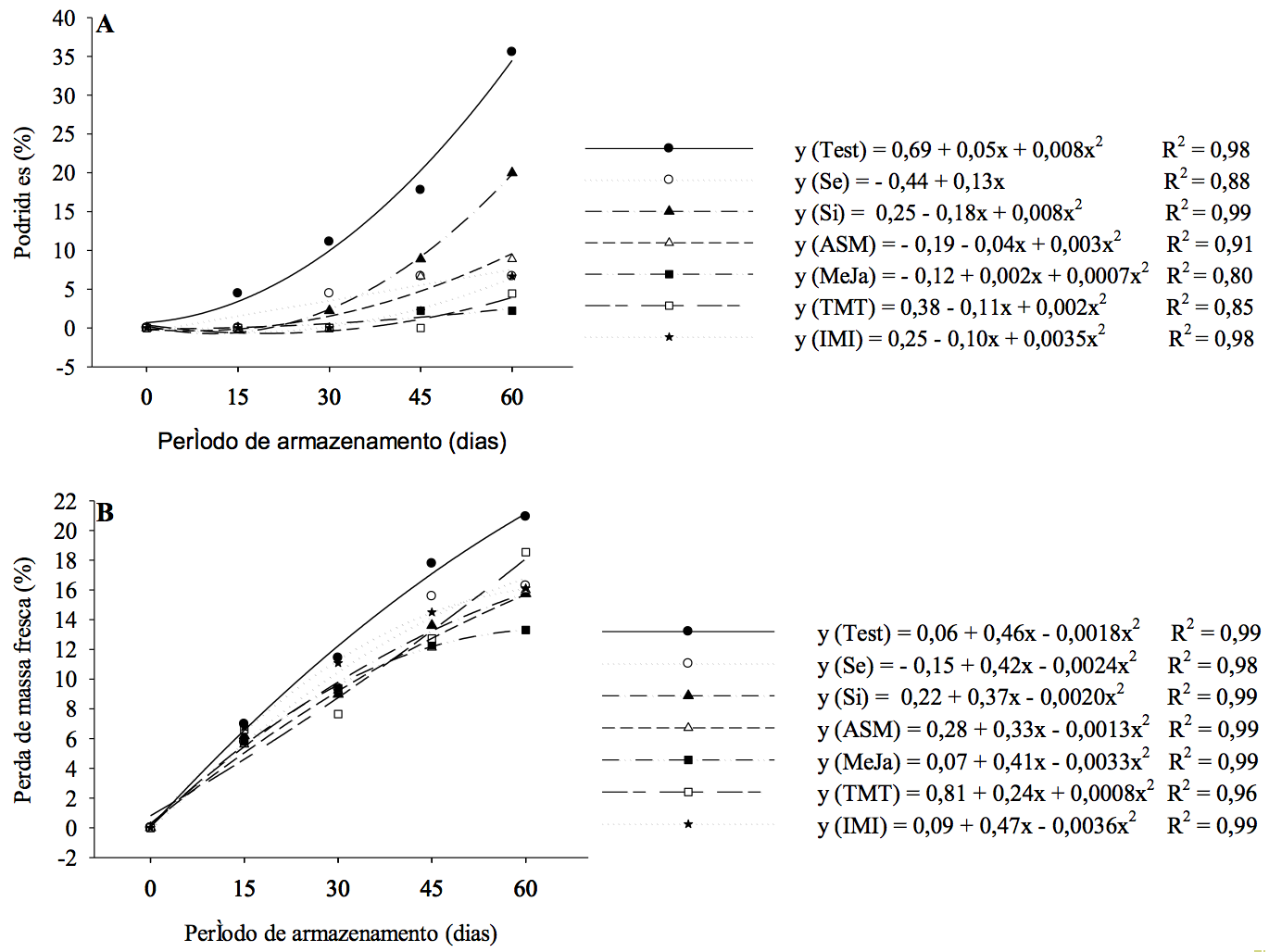
Figura 1 - Percentual de podridões (A) e perda de massa fresca (B) de tangores ‘Ortanique’ submetidos na pré-colheita aos indutores selênio (Se), silício (Si), acibenzolar-s-metil (ASM), metil-jasmonato (MeJa), tiametoxam (TMT) e imidacloprido (IMI), armazenados sob refrigeração (5±1ºC e umidade relativa de 90±5%) e posterior simulação de vida de prateleira por 7 dias (22±2ºC). Pelotas/RS, 2016.
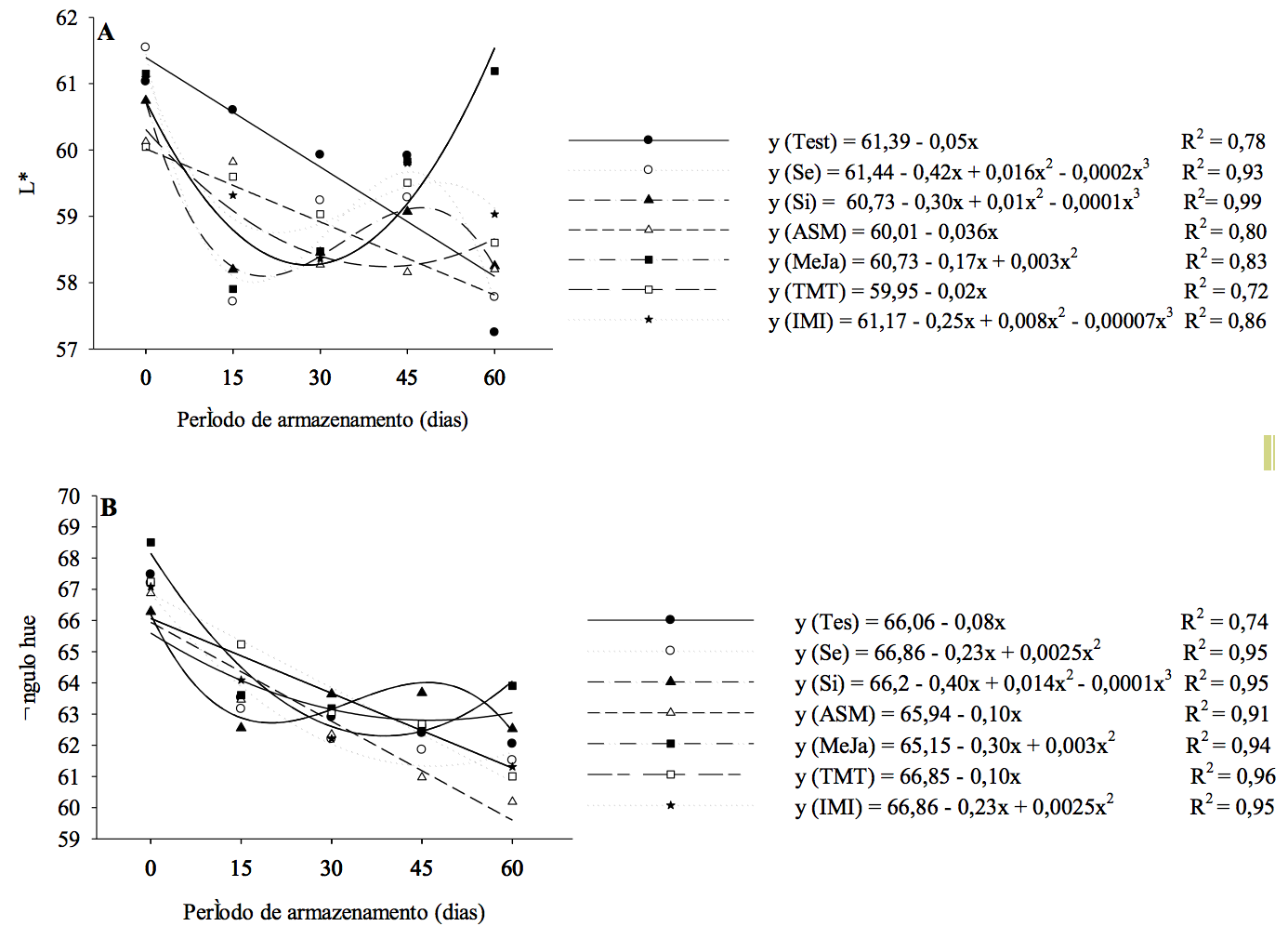
Figura 2 - Coloração L* (A) e ângulo hue (B) de tangores ‘Ortanique’ submetidos na pré-colheita aos indutores selênio (Se), silício (Si), acibenzolar-s-metil (ASM), metil-jasmonato (MeJa), tiametoxam (TMT) e imidacloprido (IMI), armazenados sob refrigeração (5±1ºC e umidade relativa de 90±5%) e posterior simulação de vida de prateleira por 7 dias (22±2ºC). Pelotas/RS, 2016.
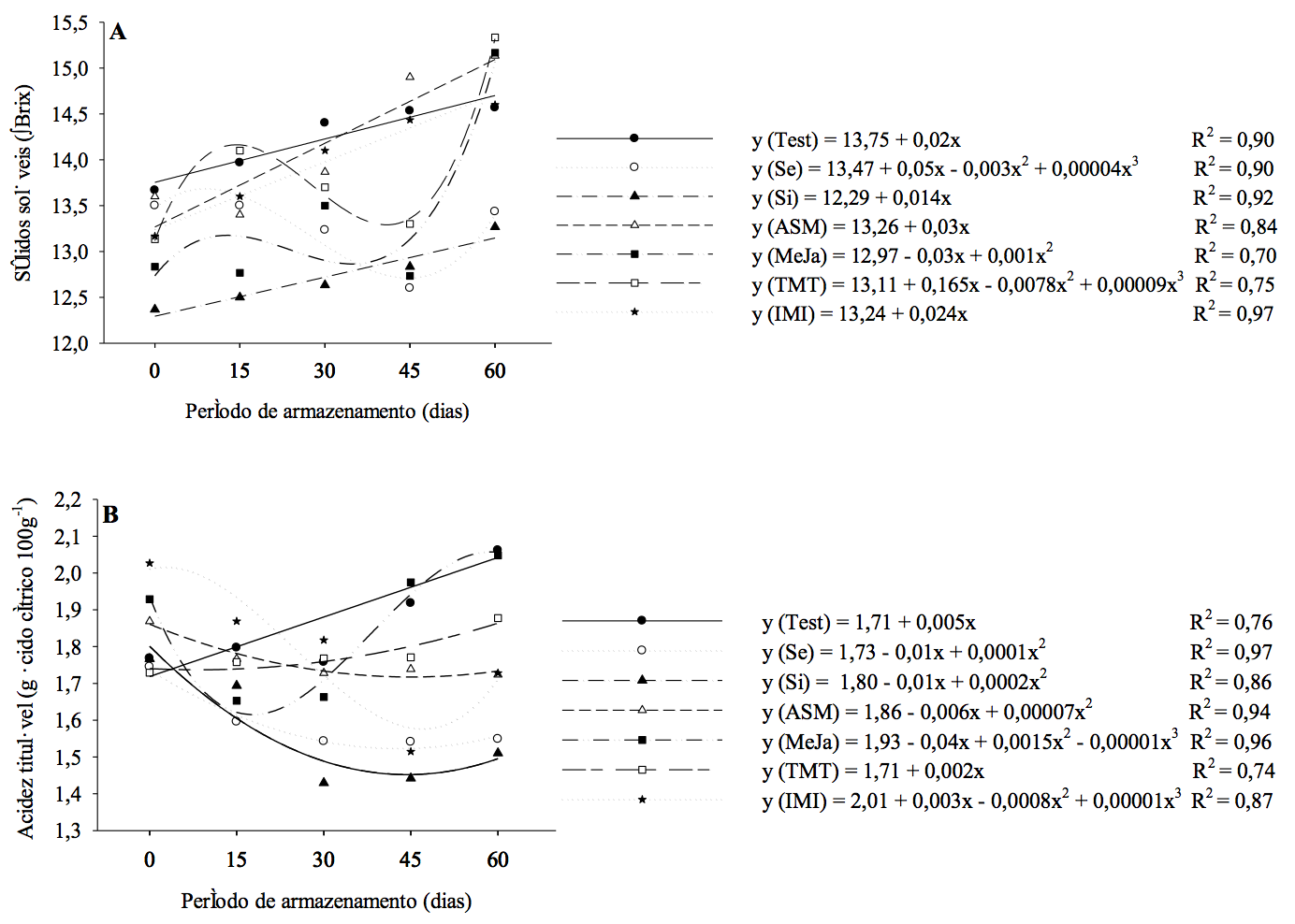
Figura 3 - Sólidos solúveis (ºBrix) (A), acidez titulável (g ácido cítrico 100g-1) (B) e ácido ascórbico (mg 100g-1) (C) de tangores ‘Ortanique’ submetidos na pré-colheita aos indutores selênio (Se), silício (Si), acibenzolar-s-metil (ASM), metil-jasmonato (MeJa), tiametoxam (TMT) e imidacloprido (IMI), armazenados sob refrigeração (5±1ºC e umidade relativa de 90±5%) e posterior simulação de vida de prateleira por 7 dias (22±2ºC). Pelotas/RS, 2016.
1. Departamento Fitotecnia. Universidade Federal de Pelotas. Eng. Agrônoma doutora em Agronomia (programa de pós-graduação em Agronomia, UFPEL). Email: marinesfaem@gmail.com
2. Departamento Fitotecnia. Universidade do Estado de Santa Catarina. Eng. Agrônoma doutoranda em Produção Vegetal (programa de pós-graduação em Produção Vegetal, UDESC). Email: pricilassilva@hotmail.com
3. Departamento Fitotecnia. Universidade Federal de Pelotas. Eng. Agrônoma doutoranda em Agronomia (programa de pós-graduação em Agronomia, UFPEL). Email: carol_fariasb@hotmail.com
4. Departamento Fitotecnia. Empresa Brasileira de Pesquisa Agroperuária. Eng. Agrônomo doutor em Ciências (programa de pós-graduação em Energia Nuclear na Agricultura, USP). Email: Roberto.pedroso@embrapa.br
5. Departamento Fitotecnia. Universidade Federal de Pelotas. Eng. Agrônomo doutor e professor em Agronomia (programa de pós-graduação em Agronomia, UFPEL). Email: malgarim@ufpel.edu.br