

Vol. 38 (Nº 36) Año 2017. Pág. 3
BARRETO, Caroline F. 1; KIRINUS, Marines, B. M. 2; GIOVANAZ, Marcos A. 3; SILVA, Pricila S. 4; NAVROSKI, Renan 5; FACHINELLO, José C. 6; MALGARIM, Marcelo B. 7
Recibido: 22/02/2017 • Aprobado: 18/03/2017
RESUMO: O objetivo deste trabalho foi avaliar o efeito da aplicação do ácido salicílico (AS) na pré e pós-colheita em pêssego ‘Rubimel’ visando o controle de podridões e conservação dos frutos. Foram aplicadas as doses 0, 1, 2 e 3 mM de AS e foram armazenados. Avaliou-se ocorrência de podridões, perda de massa, índice de maturação, cor, firmeza da polpa, sólidos solúveis, acidez titulável e pH. A incidência de podridões reduziu nas doses de 2 mM de AS aplicado na pré-colheita. |
ABSTRACT: The objective of this work was to evaluate the effect of the application of salicylic acid (AS) on pre and post harvest in 'Rubimel' peach for rot control and fruit conservation. The doses 0, 1, 2 and 3 mM of AS were applied and stored. The occurrence of rot, loss of mass, maturation index, color, flesh firmness, soluble solids, titratable acidity and pH were evaluated. The incidence of rot reduced at doses of 2 mM AS applied at the pre-harvest. |
O rápido amadurecimento dos frutos e a alta incidência de podridão parda (Monilinia fructicola) no pomar são os principais entraves para a conservação pós-colheita de pêssegos. A principal forma de controle desta doença é pela utilização de fungicidas aplicados na pré-colheita, porém, o controle químico excessivo pode resultar em resíduos nos frutos (Danner et al., 2008) e proceder na resistência do patógeno ao ingrediente ativo (Sautter et al., 2011).
Atualmente, métodos de controle alternativos que diminuam danos com podridões e auxilie na conservação dos frutos de pêssegos tem sido estudado. Neste sentido, é reportado pela literatura que o ácido salicílico (AS) apresenta potencial na conservação de frutos na pós-colheita de pêssegos (Wang et al, 2006; Khademi & Ershadi, 2013). Além da cultura do pessegueiro, o ácido salicílico apresentou resultados positivos na conservação de frutos de morango (Lolaei et al., 2012), caqui (Khademi et al., 2012) e kiwi (Zhang et al., 2003).
O ácido salicílico, além de induzir na defesa aos estresses bióticos e abióticos nas plantas (Mirdehghan & Ghotbi, 2014) está envolvido em vários processos fisiológicos e de resistência a patógenos (Hayat et al., 2007; Larqué-Saavedra & Martin-Mex, 2007). Um dos mecanismos de defesa das plantas é a resistência sistêmica adquirida que tem o AS como molécula fundamental na sinalização e atua na formação de compostos de defesa vegetal (Beckers & Spoel, 2006).
Em relação ao fruto, o AS atua no retardamento da senescência e no efeito antagônico na biossíntese do etileno (Khademi et al., 2012) com redução de até 30% na produção do hormônio etileno (Imran et al., 2007). A aplicação de AS aumenta a resistência dos frutos a injúrias por frio (Luo et al., 2011), mantém a firmeza de polpa (Asghari & Aghdam, 2010) e inibe enzimas responsáveis pela degradação da parede e membrana celular (Zhang et al., 2003).
As condições climatológicas das regiões produtoras de pêssego no Brasil são favoráveis para o desenvolvimento da podridão parda durante os ciclos de produção da cultura. Neste sentido, o objetivo deste trabalho foi avaliar o efeito da aplicação do ácido salicílico na pré e pós-colheita em pêssego ‘Rubimel’ visando o controle de podridões e a conservação dos frutos.
O experimento foi conduzido na safra 2014/2015, com aplicação de AS na pré e pós-colheita. A aplicação pré-colheita foi realizada no pomar do Centro Agropecuário da Palma (CAP), Universidade Federal de Pelotas (UFPel), no município de Capão do Leão – Rio Grande do Sul, latitude 31°52'00" S, longitude 52°21'24" W e altitude 13,24 metros. Foram utilizadas plantas de pessegueiros da cultivar Rubimel, com 6 anos de idade, enxertada sobre o portaenxerto Capdeboscq. As plantas foram conduzidas no sistema de vaso e o pomar apresenta 500 plantas ha-1, com espaçamento de 5 m entre linhas e 4 m entre plantas.
Para a realização dos tratamentos, foram selecionadas doze plantas aleatoriamente no pomar e pulverizadas com ácido salicílicos nas doses de 0, 1, 2 e 3 mM, previamente solubilizado em 20 mL de álcool etílico. As aplicações das diferentes dosagens foram realizadas por aspersão, utilizando pulverizador costal, com volume médio de calda de 1000 L ha-1. Como fonte de AS foi utilizado produto contendo 99% do ingrediente ativo (Vetec), e em todos os tratamentos foi adicionado espalhante adesivo (Silwet-77®) a 0,05%. Os frutos depois de colhidos foram transportados ao LabAgro\Fruticultura (UFPel), onde se descartou os frutos danificados, procedeu a homogeneização e separação das amostras experimentais para a determinação das características físico-químicas.
Para os tratamentos com AS na pós-colheita utilizou-se as doses de 0, 1, 2 e 3 mM de AS, previamente solubilizado em 20 mL de álcool etílico. Os frutos foram aspergidos nos dois lados utilizando um pulverizador de pressão manual. Na realização das aplicações foi utilizado em média 2 mL da solução com AS por fruto.
O delineamento experimental foi inteiramente casualizado, arranjado em esquema fatorial 7 x 4, com quatro repetições de vinte frutos. O fator A foi composto por diferentes doses (0, 1, 2, 3 mM de ácido salicílico) na pré-colheita e pós-colheita da cultura do pessegueiro. O fator B composto pelos períodos de armazenamento: dia da colheita (dia 0), dia 2, dia 4 e dia 6 em temperatura de 24±1ºC, sendo este período conhecido como vida de prateleira.
Para determinar as características físico-químicas dos frutos avaliou-se: ocorrência de frutos com podridões, determinada através do número de frutos que apresentaram sintomas visuais de podridões e expresso em porcentagem de frutos infectados; perda de massa fresca, determinada pela diferença entre a massa do fruto no momento da colheita e no período de avaliação de qualidade dos frutos, os resultados foi expresso em porcentagem (%); o índice de maturação (DA) é calculado com base na diferença de absorbância (DA) entre dois comprimentos de onda próximos do pico de absorção da clorofila-a. As leituras foram padronizada sendo realizadas em 2 pontos em cada lado dos frutos através do espectrofotômetro portátil DA meter® (Turony/Italy); cor de superfície (C), medida com leitura na porção média da amostra e realizada com colorímetro Minolta CR-300, com fonte de luz D65, com 8mm de abertura, padronizada com calibração por placa set CR-A47 contra fundo branco com leituras das coordenadas L*, a* e b*, e o matiz ou tonalidade cromática representado pelo ângulo hue (Hº); firmeza da polpa, medida com penetrômetro manual MCCornick FT 327 com ponteira de 8 mm, em dois pontos opostos na região equatorial, e os resultados expressos em N; sólidos solúveis totais (SST), obtidos através de refratômetro digital, expresso em ºBrix do suco; acidez titulável total (ATT), 10 mL de suco foram diluídos em 90 mL de água destilada e titulados até pH 8,1 com solução de NaOH 0,1 mol/L, os resultados foram em porcentagem de ácido cítrico; determinação do potencial hidrogeniônico (pH), medido através do peagâmetro Quimus. Para essas análises utilizou-se 20 frutos por repetição.
Os dados foram avaliados quanto à normalidade (teste de Sharipo-Wilk) e homocedasticidade (teste de Hartley) e, posteriormente, submetidos à análise da variância, através do Teste F, e as médias comparadas pelo teste Tukey, onde p≤0,05 e quando os tratamentos foram significativos procedeu-se análise de regressão.
A incidência de podridões nos pêssegos ‘Rubimel’ submetidos à aplicação de AS na pré-colheita e pós-colheita não diferiram significativamente, durante o segundo dia de comercialização simulada (Figura 1). No dia 4 e 6 de comercialização simulada, a dose de 2 mM de AS na pré e 1 mM de AS na pós-colheita foram mais eficientes na redução da incidência de Monilinia fructicola.
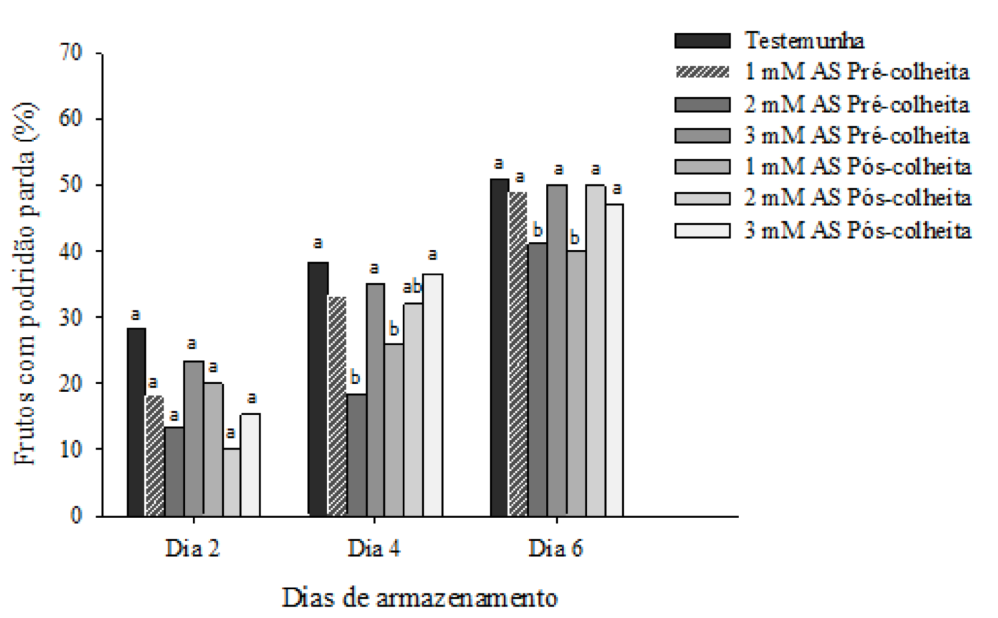
Figura 1: Porcentagem de frutos com podridão em pêssego ‘Rubimel’, da safra de 2014/2015,
com aplicação de ácido salicílico na pré e pós-colheita em comercialização simulada durante seis dias.
Na pré-colheita a dose de 2 mM de AS proporcionou as menores porcentagens de frutos com podridão parda durante o experimento com 13,33% (dia 2), 18,33% (dia 4) e 41,06% (dia 6) (Figura 1). Tem sido relatado que a aplicação AS na pré ou pós-colheita reduz a incidência de fungos no pêssego (Wang et al., 2006) e de cerejas (Xu & Tian, 2008). O AS prolonga a vida de pós-colheita devido a indução de resistência a diferentes doenças em frutos de caqui (Khademi et al., 2012) e de morango (Babalar el al., 2007; Shafiee et al, 2010). Segundo Khademi & Ershadi (2013), o AS induz a resistência através da defesa sistêmica da estimulação de enzimas antioxidantes.
Em relação às aplicações na pós-colheita, a dose de 1 mM de AS resultou na redução da porcentagem de frutos com podridão parda no dia 2 (15,30%) e dia 4 (36,30%). Entretanto, a aplicação de AS na pós-colheita, em pêssegos ‘Elberta’ na concentração de 2 mM foi mais eficaz para reduzir podridões aos 42 dias de armazenamento em temperatura de 0°C (Khademi & Ershadi et al., 2013). Em morango (Babalar et al., 2007) e caqui (Khademi et al., 2012) a dose de 2 mM de AS na pós-colheita apresentou melhor resistência a doenças.
Houve interação entre doses de AS e o tempo de armazenamento em temperatura ambiente para a firmeza, índice DA e sólidos solúveis. No momento da colheita, os frutos obtiveram firmeza de 33,3 a 30,54 Newtons. A firmeza da polpa diminuiu durante o período de armazenamento (Figura 2). As doses de AS aplicadas na pré-colheita mantiveram a firmeza dos frutos em melhores condições para o consumo até o dia 6, entretanto, os pêssegos tratados com AS na pós-colheita apresentavam frutos com baixa firmeza e inviabilizava a comercialização dos frutos.

Figura 2: Firmeza de polpa de frutos de pêssego ‘Rubimel’ tratados com ácido salicílico
e simulação de comercialização durante seis dias. Tratamentos: testemunha ( ),
1 mM de AS na pré-colheita ( ), 2 mM de AS na pré-colheita ( ), 3 mM de AS na pré-colheita ( ),
1 mM de AS na pós-colheita ( ), 2 mM de AS na pós-colheita ( ) e 3 mM de AS na pós-colheita ( ).
Regressão linear significativa na probabilidade de 5% para ambas as variáveis.
Zhang et al. (2003) e Wang et al. (2006) relataram que a aplicação exógena de AS impede amolecimento do fruto, pois o AS afeta a extensibilidade das células que proporcionam maior firmeza dos frutos (Zhang et al, 2003). O pêssego por ser uma fruta climatérica depende da produção de etileno para o amolecimento e o AS diminui a produção de etileno (Babalar et al, 2007) e inibe enzimas que degradam pectinametilesterase e poligalacturonase que reduz a taxa de amolecimento dos frutos (Asghari & Aghdam, 2010).
No momento da caracterização os frutos apresentaram DA de 1,34 a 1,0. Após o período de armazenamento de 6 dias, o índice DA na dose de 2 mM da pré-colheita do pêssego permaneceu alto (0,78) e 2 mM após a colheita teve a maior redução do DA (0,48) (Figura 2). Do mesmo modo que a firmeza da polpa, o índice de maturação diminuiu durante o período de armazenamento e as doses de AS aplicadas na pré-colheita mantiveram a firmeza e o DA dos frutos durante o armazenamento.

Figura 3: Índice de maturação (DA) de frutos de pêssego ‘Rubimel’ tratados com ácido salicílico
e armazenados 24±1°C durante seis dias. Tratamentos: testemunha ( ), 1 mM de AS na pré-colheita ( ),
2 mM de AS na pré-colheita ( ), 3 mM de AS na pré-colheita ( ), 1 mM de AS na pós-colheita ( ),
2 mM de AS na pós-colheita ( ) e 3 mM de AS na pós-colheita ( ). Regressão linear significativa na probabilidade
de 5% para ambas as variáveis.
O DA pode aproximar da identificação da maturação dos frutos, pois o índice é calculado com base na diferença de absorbância entre dois comprimentos de onda próximos do pico de absorção da clorofila-a. A exposição de frutos ao etileno estimula processos associados à maturação, como a degradação da clorofila e a síntese de carotenoides (Chitarra & Chitarra, 2005). O AS proporcionou a redução da respiração e da produção de etileno (Sayari et al., 2009; Lolaei et al., 2012; Salari et al., 2012). Conforme Zhang et al. (2003), o aumento do conteúdo de AS em frutas diminui o amolecimento, pois resulta na redução da atividade ACC oxidase e, consequentemente, reduz a produção de etileno durante os primeiros estágios de maturação do fruto.
As doses de AS aumentaram os sólidos solúveis dos frutos durante o armazenamento (Figura 2). O aumento dos sólidos solúveis durante os períodos de armazenamento pode ser devido à perda de massa que concentra o suco da fruta (Moreno et al, 2008). As doses de 1 e 2 mM de AS reduziu os sólidos solúveis totais em pêssego durante o armazenamento por 42 dias em temperatura de 0°C (Khademi & Ershadi, 2013).

Figura 4: Sólidos solúveis de frutos de pêssego ‘Rubimel’ tratados com ácido salicílico e armazenados 24±1°C
durante seis dias. Tratamentos: testemunha ( ), 1 mM de AS na pré-colheita ( ), 2 mM de AS na pré-colheita ( ),
3 mM de AS na pré-colheita ( ), 1 mM de AS na pós-colheita ( ), 2 mM de AS na pós-colheita ( ) e 3 mM de AS
na pós-colheita ( ). Regressão linear significativa na probabilidade de 5% para ambas as variáveis.
Não houve interação entre tempo de armazenamento e as doses de AS para o °Hue, pH, acidez e perda de massa fresca. Desse modo, os efeitos do tempo e doses de AS serão apresentados e discutidos isoladamente (Tabela 1).
O °Hue expressa as diferenças na coloração do pericarpo dos frutos, permitindo visualizar mudanças na coloração dos frutos de verde à amarelo (AzzolinI et al., 2004). Observa-se na Tabela 1, que a aplicação de 3 mM de AS na pós-colheita de pêssego proporcionou os maiores resultados de °Hue (79,18). Entretanto, a aplicação de 3mM na pré-colheita proporcionou os menores resultados de °Hue (70,86). Em relação aos dias de armazenamento não houve diferença significativa.
A acidez e o pH foram alteradas pela aplicação de AS, e o valor de acidez foi maior na testemunha 0,44 gramas de ácido cítrico/100 gramas de polpa e pH menor de 4,18 (Tabela 1). A dose de 3 mM de AS na pré-colheita apresentou pH alto de 4,3 e acidez titulável baixa 0,31 gramas de ácido cítrico/100 gramas de polpa. A redução da acidez com o amadurecimento dos frutos também foi observada por Danieli et al. (2002), pois ocorre uma utilização dos ácidos orgânicos no processo respiratório. Com o passar do tempo e amadurecimento dos frutos, ocorreu a diminuição da acidez e não apresentou aumento do pH nos frutos (Tabela 1).
Em decorrência do processo natural de senescência do fruto, ocorreu perda gradativa da massa fresca durante o período de armazenamento. Houve redução de 217,56 gramas de massa fresca na testemunha durante o armamento de 24°C, enquanto que nos frutos tratados com AS 2 mM na pré-colheita apresentaram perda de 94,50 gramas (Tabela 1). Conforme Alves et al, (2009), a perda de massa da matéria fresca em frutos é causada principalmente pela perda de água do fruto através dos processos de transpiração e respiração e, essa perda implica na perda de qualidade do produto.
O AS teve efeito de redução da perda de massa em frutos de morango aplicados em diferentes estágios de desenvolvimento da cultura (Lolaei et al., 2012) e em pêssego armazenados em temperatura refrigerada (Khademi & Ershadi, 2013). Entretanto, Weber et al. (2012) não encontrou diferença na perda de massa da matéria fresca de frutos de maracujazeiro tratados com ácido salicílico durante 26 dias de armazenamento refrigerado. O AS pode influenciar indiretamente na permeabilidade da membrana plasmática do pericarpo dos frutos, e deste modo, obter menor perda de água em forma de vapor para o ambiente (Rossarolla et al., 2012).
Tabela 1. Valores médios obtidos durante o armazenamento em temperatura ambiente de 24±1 ºC
para as variáveis de cor de superfície (ºHue), pH, acidez titulável (ácido cítrico/100 gramas de polpa) e
perda de massa (gramas) de pêssegos ‘Rubimel’, da safra de 2014, com a aplicação de ácido salicílico na
pré e pós-colheita
Tratamentos |
Cor de superfície |
pH |
Acidez titulável |
Perda de massa |
||||
Testemunha |
77,32 |
ab |
4,18 |
b |
0,44 |
a |
217,56 |
a |
1 mM AS na Pré-colheita |
74,95 |
ab |
4,23 |
ab |
0,39 |
ab |
192,43 |
a |
2 mM AS na Pré-colheita |
76,04 |
ab |
4,26 |
ab |
0,39 |
b |
94,50 |
c |
3 mM AS na Pré-colheita |
70,86 |
b |
4,30 |
a |
0,31 |
c |
177,75 |
ab |
1 mM AS na Pós-colheita |
74,25 |
ab |
4,24 |
ab |
0,39 |
ab |
167,06 |
ab |
2 mM AS na Pós-colheita |
73,80 |
ab |
4,22 |
ab |
0,38 |
b |
148,25 |
ab |
3 mM AS na Pós-colheita |
79,18 |
a |
4,26 |
ab |
0,40 |
ab |
109,93 |
b |
Dias de armazenamento |
|
|||||||
Dia 0 |
77,09 |
ns |
4,22 |
ns |
0,42 |
a |
0,00 |
c |
Dia 2 |
75,10 |
4,22 |
0,37 |
b |
173,50 |
b |
||
Dia 4 |
75,66 |
4,22 |
0,37 |
b |
201,42 |
b |
||
Dia 6 |
72,04 |
4,20 |
0,38 |
b |
257,92 |
a |
||
CV (%) |
8,84 |
|
2,51 |
|
11,15 |
|
38,00 |
|
*letras minúsculas distintas na mesma coluna diferem entre si ao nível de 5% de probabilidade de erro; ns não diferem estatisticamente.
A dose de 2 mM de ácido salicílico aplicado na pré-colheita de pessegueiros e 1 mM de ácido salicílico na pós-colheita reduz a incidência de podridão parda.
A dose de 2 mM de ácido salicílico aplicado reduz a perda de massa após a simulação de comercialização.
O ácido salicílico mantém a firmeza dos frutos e teores de sólidos solúveis totais.
Alves E. de O., Steffens C. A, Amarante C. V. T., Weber A., Miqueloto A., Brackmann A., (2009) Armazenamento refrigerado de ameixas ‘Laetitia’ com uso de 1-MCP e indução de perda de massa fresca. Ciência Rural, 40:30-36.
Asghari M. & Aghdam M. S. (2010) Impact of salicylic acid on postharvest physiology of horticultural crops. Trends in Food Science & Technology, 21:502-509.
Azzolini M. (2002) Fisiologia pós‐colheita de goiabas 'Pedro Sato': estádios de maturação e padrão respiratório. Dissertação. Universidade de São Paulo, Piracicaba. 112p.
Babalar M., Asghari M., Talaei A. & Khosroshahi A. (2007) Effect of pre-andpostharvest salicylic acid treatment on ethylene production, fungal decay andoverall quality of Selva strawberry fruit. Food Chemistry. 105:449–453.
Beckers GJM & Spoel SH (2006) Fine-tuning plant defense signaling: salicylate versusjasmonate. Plant Biology, 8: 1-10.
Brackmann A. et al. (2007) Indução da perda de massa fresca e a ocorrência de distúrbios fisiológicos em maçãs ‘Royal Gala’ durante o armazenamento em atmosfera controlada. Revista Brasileira de Armazenamento, 32:87-92.
Chitarra M. I. F. & Chitarra A. B. (2005) Pós-colheita de frutas e hortaliças: fisiologia e manuseio. 2ªed. Lavras, UFLA. p.785.
Danieli R., Girardi C. L., Parussolo A, Ferri V. C. & Rombaldi C. V. (2002) Efeito da aplicação de ácido giberélico e cloreto de cálcio no retardamento da colheita e na conservabilidade de caqui, Fuyu. Revista Brasileira de Fruticultura, 24:44-48.
Danner M. N., Sasso S. A. Z., Medeiros J. G. S., Marchese J. A. & Mazaro S. M. (2008) Indução de resistência à podridão-parda em pêssegos pelo uso de eliciadores em pós-colheita. Pesquisa Agropecuária Brasileira, 43: 793-799.
Hayat S., Ali B. & Ahmad A. (2007) Salicylic acid: Biosynthesis, metabolism and physiological role in plants. In: Hayat, S., and A. Ahmad (eds). Salicylic Acid-A Plant Hormone. Springer, Dordrecht. The Netherlands. p. 1-14.
Imran H., Zhang Y., Du G., Wang G. & Zhang J. (2007) Effect of Salicylic Acid (SA) on delaying fruit senescence of Huang Kum pear. Frontiers of Agriculture in China, 1: 456-459.
Khademi, O., Zamani Z., Mostofi Y., Kalantari, S. & Ahmadi A. (2012) Extending Storability of Persimmon Fruit cv. Karaj by Postharvest Application of Salicylic Acid. Journal of Agricultural Science and Technology, 14:1067-1074.
Khademi Z. & Ershadi A. (2013) Postharvest application of salicylic acid improves storability of peach (Prunus persica cv. Elberta) fruits. International Journal of Agriculture and Crop Sciences, 5-6:651-655.
Larqué-Saavedra A. & Martín-Mex R. (2007) Effects of salicylic acid on the bioproductivity of plants. In: Hayat, S., and A. Ahmad (eds). Salicylic Acid-A Plant 171 Hormone. Springer, Dordrecht. The Netherlands. p. 15- 23.
Lolaei A., Kaviani B., Rezaei M. A., Raad M. K. & Mohammadipour R. (2012). Effect of pre- and postharvest treatment of salicylic acid on ripening of fruit and overall quality of strawberry (Fragaria ananasa Duch cv. Camarosa) fruit. Annals of Biological Research, 3:4680-4684.
Luo Z, Chen C & Xie J (2011) Effect of salicylic acid treatment on alleviating postharvest chilling injury of ‘Qingnai’ plum fruit. Postharvest Biology and Technology, 62:115-120.
Machado A. A. & Conceição A. R. (2002) Sistema de análise estatística para Windows. WinStat. Versão 2.0. UFPel.
Mirdehghan S.H. & Ghotbi F. (2014) Effects of Salicylic Acid, Jasmonic Acid, and Calcium Chloride on Reducing Chilling Injury of Pomegranate (Punica granatum L.) Fruit. Journal of Agricultural Science & Technology, 16:163.
Mirdehghan, S. H.; Ghotbi, F. Effects of Salicylic Acid, Jasmonic Acid, and Calcium Chloride on Reducing Chilling Injury of Pomegranate (Punica granatum L.) Fruit. Journal of Agricultural Science & Technology, v.16, p.163, 2014.
Moreno, J. J.; Cerpa-Caldero, F.; Cohen; S. D.; Fang, Y.; Qian, M.; Kennedy, J. A. Effect of postharvest dehydration on the composition of Pinot Noir grapes (Vitis vinifera L.) and wine. Food Chemistry, v.109, p.755–762, 2008.
Moreno J. J., Cerpa-Caldero F., Cohen S. D., Fang Y., Qian M. & Kennedy J. A. (2008) Effect of postharvest dehydration on the composition of Pinot Noir grapes (Vitis vinifera L.) and wine. Food Chemistry, 109:755–762.
Rossarolla M. D., Camponogara T. T., Spiller A. C., de Melo A. M., Sanchez P. R., Sichmann Heiffig-del LA & Saavedra J del A (2012). O ácido salicílico em pré-colheita influência o controle pós-colheita de Penicillium digitatum de laranja ‘Salustiana’. Revista Iberoamericana de Tecnología Postcosecha, 13:140-145.
Salari N., Bahraminejad A., Afsharmanesh G. & Khajehpour G. (2012) Effect of salicylic acid on post-harvest quantitative and qualitative traits of strawberry cultivars. Advances in Environmental Biology, 7:94-99.
Shafiee M., Taghavi T. S. & Babalar M. (2010) Addition of salicylic acid to nutrient solution combined with postharvesttreatments (hot water, salicylic acid, and calcium dipping) improvedpostharvest fruit quality of strawberry. Scientia Horticulturae, 124:40-45.
Sautter C. K., Brackmann A., Anese R. O., Weber A., Rizzatti M. R. & Pavanello E. P. (2011) Controle da podridão-parda e características físico-químicas de pêssegos ‘Magnum’ submetidos a tratamentos pós-colheita com elicitores abióticos. Revista Ceres, 58:172-177.
Sayari M., Babalar M., Kalantari S., Alizadeh H. & Asgari M. A. (2009) Effect of salicylic acid on chilling resistance and phenylalanine ammonia lyase activity in pomegranate cultivars Mals Saveh in storage. Iranian Journal of Horticulture Sciences, 40:21-28.
Taiz L. & Zeiger E. (2013) Fisiologia vegetal. 4.ed. Porto Alegre, Artmed, 2013. 848p.
Xu X. & Tian S. (2008) Salicylicacid alleviated pathogen-induced oxidative stress inharvested sweet cherry fruit. Postharvest Biology and Technology, 49: 379385.
Wang L., Chen S., Kong W., Li S. & Archbold D. D. (2006) Salicylic acid pretreatment alleviates chilling injury and affects the antioxidant system and heat shock proteins of peaches during cold storage. Postharvest Biology and Technology, 41, 244-251.
Weber D., Jones E., Beskow T. G., Barbosa M. M., Saavedra J. & Fachinello J. C. (2012) Ácido salicílico e refrigeração na conservação de maracujás. Revista Iberoamericana Tecnología Postcosecha, 13:123-12.
Zhang Y., Chen K., Zhang S. & Ferguson I. (2003) The role of salicylic acid in postharvest ripening of kiwifruit. Postharvest Biology and Technology, 28:67-74.
1. Doutoranda em Agronomia, Universidade Federal de Pelotas, Programa de Pós Graduação em Agronomia - carol_fariasb@hotmail.com
2. Doutoranda em Agronomia, Universidade Federal de Pelotas, Programa de Pós Graduação em Agronomia - marinesfaem@gmail.com
3. Doutorando em Agronomia, Universidade Federal de Pelotas, Programa de Pós Graduação em Agronomia - giovanazmarcos@gmail.com
4. Doutoranda em Produção Vegetal, Universidade do Estado de Santa Catarina, Programa de Pós Graduação em Produção Vegetal - pricilassilva@hotmail.com
5. Mestrando em Agronomia, Universidade Federal de Pelotas, Programa de Pós Graduação em Agronomia - navroski@outlook.com
6. Professor Titular, Universidade Federal de Pelotas, Programa de Pós Graduação em Agronomia - jfachi@ufpel.edu.br
7. Professor Adjunto, Universidade Federal de Pelotas, Programa de Pós Graduação em Agronomia - malgarim@ufpel.edu.br