

Vol. 38 (Nº 31) Año 2017. Pág. 6
Daniel Soares ABRANTES 1; Reginaldo Gomes NOBRE 2; Leandro de Pádua SOUZA 3; Everaldo Mariano GOMES 4; Anielson dos Santos SOUZA 5; Fablo Fernandes de SOUSA 6
Recibido: 18/01/2017 • Aprobado: 21/02/2017
RESUMO: Objetivou-se avaliar o efeito da salinidade da água de irrigação em interação com adubação nitrogenada na formação de mudas enxertadas de goiabeira cv. Paluma, casa de vegetação no CCTA/UFCG. Usou-se a aleatorização em blocos, em esquema fatorial 5 x 4 com quatro repetições. Conclui-se que a dose de 386 mg de N dm-3 estimulou a formação das mudas enxertadas de goiabeira e a utilização de CEa de até 2,2 dS m-1, promovem redução aceitável no crescimento das plantas de 10%. |
ABSTRACT: The objective of this study was to evaluate the effect of salinity of irrigation water in interaction with nitrogen fertilization on the formation of grafted seedlings of guava cv. Paluma, greenhouse at CCTA / UFCG. Block randomization was used in a 5 x 4 factorial scheme with four replications. It is concluded that the dose of 386 mg of N dm-3 stimulated the formation of guava grafted seedlings and the use of CEa of up to 2.2 dS m-1, promotes an acceptable reduction in plant growth of 10%. Key words: Psidium guajava L., saline water, nitrogen levels. |
A goiabeira está entre as espécies frutíferas de maior valor econômico para o Nordeste brasileiro, com grande potencial para expansão, pois produzem frutos de elevado valor nutritivo e grande aceitação no mercado (Oliveira et al., 2015).
Na exploração econômica de goiabeira a produção de mudas é uma das principais etapas, pois, tem influência na obtenção de plantas precoces, saudáveis e com alto potencial produtivo. Os produtores de mudas normalmente usam como porta-enxerto, materiais genéticos de goiabeiras que sejam rústicos e de boa adaptação a condições adversas locais, fatores estes que podem colaborar no alcance de rendimentos satisfatórios mesmo em condição de estresse hídrico e/ou salino, sendo a goiabeira Crioula uma alternativa bastante utilizada em viveiro de produção de mudas (Natale, 2009).
Associado a importância do material vegetal escolhido na produção de mudas e os longos períodos de estiagem e a irregularidade anual das precipitações no semiárido do Nordeste brasileiro torna a prática da irrigação imprescindível para se garantir a produção agrícola com segurança (Lima et al., 2014).
Nas regiões semiáridas a escassez hídrica é uma realidade, sendo comum o uso de águas de poços que nem sempre possuem qualidade adequada para irrigação, contribuindo assim, com o aumento dos teores salinos no solo e em consequência, podem ocorrer estresses osmóticos, tóxicos e de natureza nutricional sobre as culturas, afetando o desenvolvimento e a produção das culturas (Leite et al., 2007).
A tolerância das plantas à salinidade varia em função da espécie vegetal, das cultivares de uma mesma espécie e de fatores como tipo e concentração de sal, tempo de exposição, estádio fenológico, tal como da interação entre eles (Neves et al., 2008).
Assim, o uso de águas salinas na agricultura fica condicionado à tolerância das culturas à salinidade e ao manejo de práticas como irrigação e adubação. Conforme Souza et al. (2016) a goiabeira, na formação de porta-enxerto, sob estresse salino responde até 773 mg de N dm-3 do solo. Dessa forma, o manejo adequado da adubação nitrogenada pode ser uma alternativa para atenuar os efeitos da salinidade da água de irrigação sobre as plantas.
Segundo Medeiros et al. (2012), a fertirrigação tem assumido papel preponderante, no manejo de culturas irrigadas nessa região, sendo o nitrogênio, um dos principais macronutrientes utilizados por participa diretamente no metabolismo das plantas, atuando como constituinte da molécula de clorofila, ácidos nucléicos, aminoácidos e proteínas (Oliveira et al., 2010).
Neste sentido, objetivou-se com este trabalho avaliar o efeito da salinidade da água de irrigação em interação com adubação nitrogenada na formação de mudas enxertadas de goiabeira cv. Paluma, tendo como porta-enxerto a goiabeira Crioula.
O experimento foi realizado de Abril de 2014 a maio de 2015, em ambiente protegido, no Centro de Ciências e Tecnologia Agroalimentar (CCTA) da Universidade Federal de Campina Grande (UFCG), Campus de Pombal. O município de Pombal - PB, situa-se a uma altitude média de 184 metros, cujas coordenadas geográficas locais de referência são 06°47’20’’ S, 37°48’01’’ W.
Usou-se o delineamento experimental em blocos casualizados, em esquema fatorial 5 x 4, com os tratamentos resultantes da combinação entre os fatores salinidade da água de irrigação em cinco condutividades elétricas (CEa): S1 - 0,3; S2 - 1,1; S3 - 1,9; S4 -2,7 e S5 - 3,5 dS m-1 e quatro doses de nitrogênio: N1 - 70% (386 mg dm-3 de solo), N2 - 100% (552 mg dm-3), N3 - 130% (717 mg dm-3) e N4 - 160% (883 mg dm-3), utilizando quatro repetições, com três plantas por parcela.
As CEa foram preparados a partir de água de CE de 0,3 dS m-1, mediante adição de NaCl, CaCl2.2H2O e MgCl2.6H2O, na proporção 7:2:1, sendo esta proporção comumente encontrada nas águas utilizadas para irrigação na região Nordeste do Brasil (Medeiros, 1992). As doses de N foram determinadas com base na dose de 552 mg de N dm-3 de solo recomendada por Franco et al. (2007) para mudas de goiabeira cv. Paluma propagadas por estacas herbáceas e cultivadas em cultivo hidropônico, sendo este valor considerado 100% de N.
Para a formação do porta-enxerto utilizou-se como recipientes, sacolas de polietileno, com volume de 1150 mL (25 cm de altura e 13 cm de diâmetro) e possuindo orifícios na parte lateral (1/3 inferior) para permitir livre drenagem. As sacolas foram preenchidas com substrato composto por solo (Neossolo Regolítico Eutrófico com textura franco-arenosa), coletado a uma profundidade de 0-30 cm, proveniente do município de Pombal – PB e adicionado 2% de esterco bovino curtido, visando melhorar a estrutura físico do solo. Após o preparo do substrato realizou-se análises (Tabela 1) conforme Claessem (1997).
As sacolas preenchidos com o substrato foram dispostos em bancadas metálicas, a uma altura de 0,8 m do solo.
Usou-se o genótipo de goiabeira Crioula como porta-enxerto, propagados a partir de sementes obtidas em propriedades rurais do município de Pombal – PB. A semeadura foi realizada a uma profundidade de 0,5 cm, com quatro sementes por sacola. Após a emergência, realizou-se o desbaste quando as plântulas apresentavam dois pares de folhas, deixando uma planta por sacola, a mais vigora. As irrigações dos porta-enxertos foram feitas diariamente de acordo com a necessidade hídrica das plantas, mediante uso de água de CE de 0,3 dS m-1.
Os porta-enxertos de goiabeira foram conduzidos em haste única e, após atingirem o diâmetro recomendado para enxertia, entre 4 a 5 mm (Chaves et al., 2000), 240 dias após o semeio, foi realizada a enxertia do tipo garfagem em fenda cheia, a 7 cm de altura acima do colo planta, tendo como enxerto (garfo) material oriundo de goiabeira cv. Paluma, coletado em um pomar comercial conduzido no lote agrícola familiar Nº 05 setor VI, localizado no Perímetro Irrigado Várzeas de Sousa, Sousa - PB.
Após o surgimento das brotações nas plantas enxertadas, e antes da aplicação dos tratamentos, foi realizada uma poda, deixando apenas um ramo por planta, ou seja, para conduzir a muda em haste única.
Passados 30 dias da realização da enxertia, foi iniciada a aplicação dos tratamentos (águas salinizadas e doses de nitrogênio). As irrigações com águas de distintos tratamentos foram realizadas diariamente, no final da tarde, com base na necessidade hídrica da planta, pelo processo de lisimetria de drenagem, sendo aplicado diariamente o volume retido na sacola, determinado pela diferença entre o volume aplicado e o volume drenado da irrigação anterior, conforme o tratamento. Aplicou-se uma fração de lixiviação de 10% para cada tratamento, como forma de reduzir a salinidade do extrato de saturação do substrato.
A adubação nitrogenada foi parcelada em quatro aplicações, em intervalos de 7 dias, utilizando-se como fonte de nitrogênio a ureia (45% de N), com aplicações realizadas via fertirrigação com água de condutividade elétrica de 0,3 dS m-1 para todos os tratamentos. Usou-se esta água no intuito de evitar incrementos na CEa de cada tratamento pela salinidade do fertilizante diluído na água, o que poderia aumentar o estresse salino sobre as plantas.
A formação das mudas foi avaliada através das variáveis, comprimento do ramo (CR), diâmetro do caule (DC)acima do ponto de enxertia e no ponto de enxertia (DCPE) e área foliar (AF)aos 80 e 100 dias após a enxertia - DAE; taxa de crescimento absoluto (TCAaf) e relativo da área foliar da planta (TCRaf) no intervalo de 50 à 100 DAE, fitomassas fresca (FFPA) e seca da parte área (FSPA), fitomassa seca total (FST) e o índice de qualidade de Dickson (IQD) aos 100 DAE.
Para medição do CR foi considerado a distância entre ápice do ramo e sua inserção com o caule. No DC e DCPE, utilizou-se o paquímetro digital, sendo o DC medido a 2 cm após o primeiro nó do material vegetativo enxertado e o DCPE no ponto central da junção do enxerto com o porta-enxerto.
A AF foi determinada medindo-se as folhas que apresentavam o limbo foliar totalmente aberto, conforme Equação 1 e Lima et al. (2012), considerando a
![]()
Onde: AF= Área Foliar (cm²) e C = comprimento da nervura principal da folha (cm)
As TCAaf e TCRaf foram determinadas de acordo com metodologia descrita por Benincasa (2003), conforme as Equações 2 e 3.

Em que: TCAaf = taxa de crescimento absoluto (cm dia-1) e relativo (TCRaf) da área foliar (mm mm-1 dia-1), AF1 = área foliar (cm) no tempo t1, AF2 = área foliar (cm) no tempo t2, T1 – T2 = diferença de tempo entre as amostragens e ln = logaritmo natural.
Na mensuração da FFPA fez-se um corte no caule das plantas rente ao solo, sendo pesadas imediatamente em balança de precisão. Após a pesagem das massas fresca, as partes vegetativas da parte aérea e raiz (extraídas do substrato com auxílio de uma peneira de 3 mm) foram acondicionadas em sacos de papel, devidamente identificados e postos para secar em estufa de circulação forçada de ar a 65ºC até atingir o peso constante. Em seguida, pesou-se a FSPA e FSTesta ultima através do somatório da FSPA com a FSR.
O índice de qualidade de Dickson (IQD) para mudas foi determinado por meio da fórmula de Dickson et al. (1960), descrita pela equação 4.
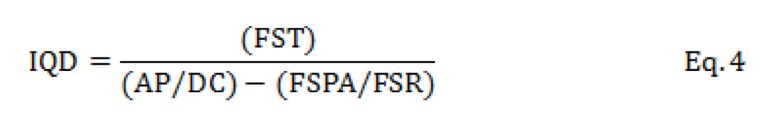
Em que: IQD = índice de qualidade de Dickson, FST = fitomassa seca total de planta (g), AP = altura de planta (cm), DC = diâmetro do caule (cm), FSPA = fitomassa seca da parte aérea (g) e FSR = fitomassa seca de raiz (g).
As variáveis foram avaliadas mediante análise de variância, pelo teste F (1 e 5% de probabilidade) e, nos casos de efeito significativo, realizou-se análise de regressão polinomial linear e quadrática, utilizando-se do software estatístico SISVAR.
Constata-se no resultado da análise variância (Tabela 2), que houve efeito significativo da salinidade da água de irrigação sobre o comprimento do ramo (CR) e área foliar (AF) aos 80 e 100 DAE, e sobre o diâmetro do caule no ponto de enxertia (DCPE) e diâmetro do caule (DC), aos 100 DAE. Referente ao fator adubação nitrogenada, observa-se efeito significativo sobre CR e AF aos 80 e 100 DAE, e DCPE aos 100 DAE. Não se constatou interação significativa entre os fatores salinidade da água e doses de nitrogênio (S x DN) sobre estas variáveis.
Analisando os dados de CR, verifica-se que o aumento da salinidade causou decréscimo linear (Figura 1A), havendo redução de 4,40% e 6,05% por aumento unitário da CEa aos 80 e 100 DAE, respectivamente, ou seja, redução de 17,62% e 24,21% nas plantas submetidas ao maior nível salino (3,5 dS m-1) em relação às irrigadas com CEa de 0,3 dS m-1. Denota-se que a salinidade tenha atuado de forma negativa sobre os processos fisiológicos, reduzindo a absorção de água, inibindo a atividade meristemática e o alongamento celular, advindo, como consequência, a redução do crescimento da planta (Freire, 2010).
Efeito semelhante foram observados por Cavalcante et al. (2010) e Gurgel et al. (2007), em que verificaram decréscimos lineares de 11% e 12,9% na altura de plantas de mudas de goiabeira das Cvs. Paluma e Ogawa, por aumento unitário na CEa aos 70 e 80 dias após a semeadura, respectivamente, avaliando os níveis de CEa de 0,5 a 4,5 dS m-1.
O aumento na dose N causou redução sobre o CR aos 80 e 100 DAE, onde os dados ajustaram-se ao modelo linear (Figura 1B), havendo perdas de 17,43% (3,39 cm) e 18,12% (4,35 cm) respectivamente, nas plantas que receberam a dose 160% de N em relação às adubadas com 70% de N, ou seja, 5,81% e 6,04% para aumento de cada 30% na dose de N nos respectivos períodos de avaliação. Tanto aos 80 quanto aos 100 DAE a menor dose, 70% de N (378 mg dm-3), foi suficiente para que as mudas enxertadas atingissem o maior CR, que obteve valores de 15,17 e 19,10 cm, respectivamente. Esta concentração de N é inferior a recomenda por Franco et al. (2007), que é de 552 mg de N por planta para produção de mudas de goiabeira Paluma, e de Dias et al. (2012), em que o maior valor da variável foi obtido na dose de 762 mg de N dm-3, denotando que as condições de condução do presente trabalho, influenciaram para a redução da necessidade de N pelas plantas.
Conforme equações de regressão (Figura 2A), verifica-se que o aumento da CEa provocaram decréscimos lineares sobre o DC e DCPE aos 100 DAE, causando reduções de 2,06% e 1,57% por aumento unitário da CEa, cujos decréscimos resultaram em perdas de 0,46 mm (DC) e 0,49 mm (DCPE) nas plantas irrigadas com água de maior salinidade (3,5 dS m-1) em comparação com as plantas irrigadas com água de menor CEa (0,3 dS m-1), indicando que o estresse salino inibe o crescimento das plantas em diâmetro, em trabalhos desenvolvidos por Cavalcante et al. (2007) também verificaram decréscimos no diâmetro do caule em função do incremento de sais na água de irrigação.
Outrossim, Gurgel et al. (2007) observaram redução 8,7% por aumento unitário na CEa sobre o DC de porta-enxertos de goiabeira cv. Rica aos 80 dias após a emergência
O aumento das doses de nitrogênio inibiu o crescimento do DCPE das mudas de goiabeira aos 100 DAE (Figura 2B), causando declínio de 0,39 mm (5,82%) nas plantas adubadas com a dose de 160% de N em relação às que receberam 70% de N, ou seja, decréscimo de 1,94% por aumento de 30% na dose de N. Segundo Garcia et al. (2010), com o incremento dos níveis de salinidade do solo, possivelmente, a redução do potencial osmótico pode causar resistência à absorção de água pelas plantas e, como consequência, a redução no crescimento das culturas. Segundo Munns, (2006) o qual diminui o potencial osmótico próximo à rizosfera, afetando a absorção de água pela planta e turgescência das células, comprometendo o crescimento e a divisão celular, e consequentemente, o crescimento do diâmetro do caule.
Em relação à AF, observa-se (Figura 3A) que o aumento da salinidade da água de irrigação afetou negativamente, promovendo decréscimo linear de 6,23% e 7,37% por incremento unitário da CEa aos 80 e 100 DAE, respectivamente, resultando em decréscimos de 36,35 cm2 e 55,69 cm2 nas plantas irrigadas com CEa de 3,5 dS m-1, em relação às plantas que receberam água de menor CEa (0,3 dS m-1). Assim como verificado para o CR (Figura 1A), observa-se que a AF (Figura 3A) foi mais afetada no período de 100 DAE, isto, provavelmente, devido o maior tempo de exposição das plantas à salinidade da água de irrigação. Semelhantemente, Cavalcante et al. (2010) observaram em mudas goiabeira que a AF decresceu linearmente com o aumento da salinidade da água de irrigação.
O incremento das doses de N aos 80 e 100 DAE, afetou negativamente a AF (Figura 3B), causando decréscimo de 7,42% e 6,40%, respectivamente, por aumento de 30% na dose de nitrogênio, ou seja, reduções de 47,37 e 44,86 cm² aos 80 e 100 DAE, respectivamente, nas plantas adubadas com a dose de 160% em relação às que receberam 70% de N. Observa-se que em ambas as épocas a menor dose de 70% N (386 mg dm-1) proporcionou maior área foliar de plantasAlmeida et al. (2006), também verificaram pouca exigência de N (150 mg dm-3) para o melhor desenvolvimento da área foliar de mudas de maracujazeiro, quando avaliaram as doses de 0 a 600 mg dm-3.
Conforme resumo da análise de variância (Tabela 3), verifica-se que houve efeito significativo do fator salinidade da água de irrigação sobre as fitomasssas fresca (FFPA) e seca da parte aérea (FSPA), seca total (FST) e índice de qualidade de Dickson (IQD) aos 100 DAE; e taxa de crescimento absoluto (TCAaf) e relativo (TCRaf) da área foliar no intervalo de 50 a 100 DAE. O fator doses de nitrogênio exerceu efeito significativo sobre as variáveis FFPA, FSPA e TCAaf nos períodos avaliados. Constatou-se ainda interação significativa entre os fatores salinidade da água de irrigação e doses de nitrogênio (S x DN) para o IQD aos 100 DAE.
A FFPA e a FSPA sofreram efeito linear decrescente em função do aumento da salinidade da água de irrigação aos 100 DAE (Figura 4A), que causou decréscimos de 33,83% (5,49 g) e 28,32% (1,76 g) sobre as respetivas variáveis, nas plantas irrigadas com CEa de 3,5 dS m-1, em relação às sob menor CEa (0,3 dS m-1), ou seja, houve diminuições de 8,45% e 7,08% por incremento unitário da CEa.
Segundo Leite et al. (2007) a salinidade da água de irrigação ou do solo, pode causar desbalanço iônico e promover toxidez no vegetal, principalmente, pela presença de íons de Na+ e Cl-, alterando o crescimento e a produção de matéria fresca e seca. Redução de 18,44% sobre a FSPA de mudas de goiabeira da cv. Rica irrigadas com água de 4,5 dS m-1 em relação às plantas que receberam água de CEa de 0,5 dS m-1 foi observado Gurgel et al. (2007).
De acordo com a equação de regressão (Figura 4B), constata-se que o incremento na adubação nitrogenada promoveu efeito linear decrescente sobre a FFPA e FSPA das mudas de goiabeira aos 100 DAE, causando reduções de 5,48% e 5,73%, respectivamente, por aumento de 30% da dose de N, ou seja, houve decrescimo na FFPA e FSPA 16,46% e 17,19%, nas plantas que foram adubadas com 160% de N em relação as que receberam 70% de N.
Verifica-se que o aumento da adubação com N afetou negativamente ambas fitomassas, entretanto, a FSPA foi mais afetada na dose de 160% de N. De acordo com Flores et al. (2002), a medida em que se aplica quantidades de nutrientes superiores ao requerido, o crescimento e acúmulo de fitomassas nas plantas pode ser prejudicado devido a competição entre nutrientes presentes na solução do solo e/ou ao efeito salino do adubo do aplicado em excesso. Com isso, observa-se (Figura 4A) que a adubação com a menor dose de N, ou seja, 386 mg dm-3 proporcionou maiores valores para ambas variáveis, supostamente pelo fato de as plantas requerem para seu bom desenvolvimento valores próximos a esta concentração de N.
O aumento da CEa da água de irrigação promoveu redução sobre a FST de plantas de goiabeira aos 100 DAE (Figura 5), havendo melhor adequação dos dados em equação linear, onde verificou-se diminuição de 6,98% (0,64 g) por aumento unitário de CEa. Em meio salino a redução no consumo de água e na absorção de nutrientes pelas plantas tem sido frequentemente observada, e desta forma, o crescimento, desenvolvimento e produção de fitomassa da planta pode ser diretamente afetada (Khan & Panda, 2008).
O aumento da salinidade na água de irrigação exerceu efeito linear decrescente sobre a TCAaf no intervalo de 50 a 100 DAE, causando redução de 10,54% por aumento unitário na CEa, ou seja, 42,17% nas plantas irrigadas com água de CEa de 3,5 dS m-1 em relação às que receberam CEa de 0,3 dS m-1 (Figura 6A). A redução desta variável, em razão do estresse salino, pode estar relacionada ao desvio de substratos energéticos responsáveis pelo crescimento das plantas, para a síntese de solutos orgânicos, de modo a realizar o ajustamento osmótico (Munns, 2006), ou mesmo, no efeito sobre a turgescência que afeta o crescimento e a divisão celular (Freire, 2010).
De acordo com a equação de regressão (Figura 6B) verifica-se que as doses crescentes de N causou efeito linear sobre a TCRaf no período de 50 a 100 DAE, com redução de 7,76% por incremento de 30% na dose de N, ou seja, 23,28% nas plantas adubadas com 160% de N comparadas com às adubadas com 70% de N. Denota-se que a inibição da TCAaf ocorreu devido aos efeitos tóxicos dos sais absorvidos pelas plantas e à baixa capacidade de ajustamento osmótico da cultura provocado pela irrigação com águas salinizadas, esses resultados são semelhantes aos obtidos por Silva et al. (2009), que observaram redução na área foliar das plantas com o aumento da salinidade na água de irrigação.
Observa-se que o aumento da CEa exerceu efeito linear decrescente sobre a TCRaf no intervalo de 50 a 100 DAE (Figura 7), causando declínio de 6,85% por aumento unitário na CEa, ou seja, 27,42% nas plantas que receberam CEa de 3,5 dS m-1 em relação às irrigadas com CEa de 0,3 dS m-1. Os efeitos do excesso de sais solúveis na solução do solo, principalmente o Na e o Cl, provocam redução do desenvolvimento vegetal, especialmente nas espécies mais susceptíveis, promovendo distúrbios fisiológicos (Farias et al., 2009).
Analisando a interação salinidade x adubação nitrogenada sobre o Índice que qualidade de Dickson (Figura 8), constata-se que o melhor ajuste dos dados ocorreu em equações quadráticas na utilização das doses de 100% e 130% de N, com os maiores valores de IQD obtidos sob os níveis de CEa de 0,8 (1,17) e 1,4 (1,35) dS m-1 nas respectivas doses de N. O uso da dose de 70% de N ocasionou efeito linear decrescente sobre a qualidade das mudas enxertadas com o aumento da salinidade da água, proporcionando redução de 7,65% no IQD por aumento unitário na CEa. Com isso, indicando que esta dose de N não foi suficiente para promover redução do estresse salino nas plantas. Em relação à dose de 160% de N, não foi verificado efeito significativo.
Neste contexto, salienta-se que o uso da adubação nitrogenada nas doses de 100% e 130% de N, atenuaram o efeito do estresse salino nas plantas, atribuindo maior qualidade das mudas enxertadas até níveis de CEa de 0,8 e 1,4 dS m-1, respetivamente. A adubação nitrogenada pode reduzir os efeitos da salinidade nas plantas promovendo maior crescimento e incrementar ganhos de produtividade (Dias et al., 2012), assim reestabelecendo equilíbrio nutricional e intensificando a produção e acúmulo de solutos orgânicos, como aminoácidos, proteínas, prolina, entre outros, o quais eleva a capacidade de ajustamento osmótico nas plantas, aumentando a resistência das culturas ao estresse salino (Silva et al., 2008).
Apesar de terem ocorrido reduções no crescimento, ao final do experimento, as mudas enxertadas de goiabeira cultivadas sob irrigações com águas de CEa de 1,9 dS m-1 e a dose de 70% de N encontravam-se aptas para ir ao campo conforme critérios para obtensão de muda padrão de goiabeira ( Chaves et al., 2000), atingindo média de 39,5 cm de altura, 6 pares de folhas aos 11 meses de idade, com sistema radicular desenvolvido, sem raízes enoveladas, retorcidos ou quebradas e com ausência de pragas, doenças e ervas daninhas. Conforme Bosco et al. (2009) plantas cultivadas sob salinidade tendem a absorver menos nitrogênio enquanto que os níveis de Cl absorvidos e acumulados são acrescidos.
Outrossim, considerando redução aceitável no crescimento das mudas de 10%, e analisando os resultados das variáveis estudas, comprimento ramo, diâmetro do caule e no ponto de enxertia, área foliar, fitomassa fresca e seca da parte aérea, fitomassa seca total, taxa de crescimento absoluto e relativo da área foliar e o índice de qualidade de Dickson, observou-se, em termo de média, que as mudas de goiabeira cv. Paluma podem ser produzidas utilizando-se de irrigação com águas com CEa de até 2,2 dS-1 .
O manejo utilizado no experimento pode ter sido fator determinante para formação das mudas de goiabeira. Denota-se que a aplicação da lamina de lixiviação tenha contribuído para evitar a concentração excessiva de sais junto ao sistema radicular das plantas permitindo assim que ocorressem apenas pequenas reduções no crescimento que, no entanto, não comprometem sua condição de ir a campo, demonstrando assim a possibilidade rentável de exploração da atividade e o aproveitamento destas com concentrações de sais mais elevadas água (NEVES et al., 2009).
1. A formação de mudas de goiabeira Paluma enxertadas com porta-enxerto crioula foi afetada negativamente pelo aumento da CEa a partir de 0,3 dS m-1;
2. A dose de 386 mg de N dm-3 estimulou a formação das mudas enxertadas de goiabeira;
3. As doses de 552 e 717 mg de N dm-3 de solo, atenuaram o efeito do estresse salino sobre o índice de qualidade de Dickson nas mudas, proporcionando maiores valores nas CEa de 0,8 e 1,4 ds m-1, respectivamente.
4. A utilização de águas com CEa de até 2,2 dS m-1, na irrigação de mudas enxertadas de goiabeiras, promovem redução aceitável no crescimento das plantas de 10%.
ALMEIDA, E.V., NATALE, W., PRADO, R.M., BARBOSA, J.C. (2006). Adubação nitrogenada e potássica no desenvolvimento de mudas de maracujazeiro. Ciência Rural, v.36, n.4, p.1138-1142.
BENINCASA, M.M.P. (2003). Análise de crescimento de plantas, noções básicas. 2 ed. Jaboticabal: FUNEP, 41 p.
BOSCO, M. R. O. DE; OLIVEIRA, A. B. DE; HERNANDEZ, F. F. F.; LACERDA, C. F. DE (2009). Influência do estresse salino na composição mineral da berinjela. Revista Ciência Agronômica, v. 40, (2), 157-164.
CAVALCANTE, L. F. RODOLFO JUNIOR F; SÁ JR; CURVELO CRS; MESQUITA E. F. (2007). Influência da água salina e matéria orgânica no desempenho do maracujazeiro amarelo e na salinidade do substrato. Irriga, Botucatu, v. 12, n. 4, p. 505-518, 2007
CAVALCANTE, L.F., VIEIRA, M.S., SANTOS, A.F., OLIVEIRA, W.M., NASCIMENTO. J.A.M. (2010). Água salina e esterco bovino liquido na formação de mudas de goiabeira cultivar Paluma. Revista Brasileira de Fruticultura, v. 32, n. 1, p. 251-261.
CHAVES, J.C.M., CAVALCANTE JÚNIOR, A.T., CORREIA, D., SOUZA, F.X., ARAÚJO, C.A.T. (2000). Normas de produção de mudas. Fortaleza: Embrapa Agroindústria Tropical, 37p.
Claessem, M.E.C. (1997). Manual de métodos de analise de solo. Ver. Atual. Rio de Janeiro: Embrapa- CNPS, p. 212.
DIAS, M.J.T., SOUZA, H.A., NATALE, W., MODESTO, V.C., ROZANE, D.E. (2012).Adubação com nitrogênio e potássio em mudas de goiabeira em viveiro comercial. Ciências Agrárias, v. 33, p. 2837-2848.
DICKSON, A., LEAF, A.L.; HOSNER, J.F. (1998). Quality appraisal of white spruce and white pine seedling stock in nurseries. The Forest Chronicle, v. 36, n. 1, p. 10-13, 1960. Ebert, G. Growth, ion uptake and gas exchange of two Annona species under salt stress. Angewandte Botanik, Berlin, v. 72, p. 61-65.
FARIAS, S. G. G. (2009). Estresse salino no crescimento inicial e nutrição mineral de Gliricídia (Gliricidia sepium (Jacq.) Kunt ex Steud) em solução nutritiva. Revista Brasileira de Ciência do Solo, v. 33, p. 1499-1505.
FRANCO, F.C.; PRADO, R. DE M.; BRACHIROLLI, L.F.; ROZANE, D. E. (2007). Curva de crescimento e marcha de absorção de macronutrientes em mudas de goiabeira. Revista Brasileira de Ciência do Solo, v. 31, n. 6, p. 1429-1437.
FREIRE, A.L.O. (2010). Crescimento, acúmulo de íons e produção de tomateiro irrigado com água salina. Semina: Ciências Agrárias, v. 31, suplemento 1, p. 1133-1144.
GARCIA, G. DE O.; NAZÁRIO, A.A.; MORAES, W.B.; GONÇALVES, I.Z.; MADALÃO, J.C. (2010). Respostas de genótipos de feijoeiro à salinidade. Engenharia na Agricultura, Viçosa, MG, v.18, n.4.
GURGEL, M.T., GHEYI, H.R., FERNANDES, P.D., SANTOS, F.J.S.S., NOBRE, R.G. (2007). Crescimento inicial de porta-enxertos de goiabeira irrigados com águas salinas. Caatinga, v.20, n.2, p.24-31.
KHAN, M.H., PANDA, S. K. (2008). Alterations in root lipid peroxidation and antioxidative responses in two rice cultivars under NaCl-salinity stress. Acta Physiologiae Plantarum, v.30, p.81-89.
LEITE, E.M., CAVALCANTE, L.F., DINIZ, A.A., SANTOS, R.V., ALVES, G.S., CAVALCANTE, I.H.L. (2007). Correção da sodicidade de dois solos irrigados em resposta à aplicação de gesso agrícola. Irriga, v.12, p.168-176.
LIMA, G. S., NOBRE, R. G., GHEYI, H.R., SOARES, L. A. DA. A., SILVA, A, O. D. (2014). Crescimento e componentes de produção da mamoneira sob estresse salino e adubação nitrogenada. Revista Engenharia Agrícola, v. 34, n. 05, p. 854-866.
LIMA, L.G.S., ANDRADE, A.C., SILVA, R.T.L., FRONZA, D., NISHIJIMA, T. (2012). Modelos matemáticos para estimativa de área foliar de goiabeira (Psidium guajava L.). In: 64ª REUNIÃO ANUAL DA SBPC. São Luiz: UFMA.
MEDEIROS, J.F. (1992). Qualidade de água de irrigação e evolução da salinidade nas propriedades assistidas pelo GAT nos Estados de RN, PB e CE. 173f. (Dissertação Mestrado). Universidade Federal da Paraíba.
MEDEIROS, P. R., DUARTE, S. N., UYEDA. C. A., SILVA, Ê. F. F., MEDEIROS, J. F. DE. (2012). Tolerância da cultura do tomate à salinidade do solo em ambiente protegido. Revista Brasileira Engenharia Agrícola e Ambiental, v. 16, n. 01, p. 51-55.
MUNNS, R., JAMES, R.A., LAUHLI, A. (2006). Approaches to increasing the salt tolerance of wheat and other cereals. Journal of Experimental Botany, v. 57, p. 1025–1043.
NATALE, W. (2009). Calagem, adubação e nutrição da cultura da goiabeira. FCAV/Unesp, campus Jaboticabal 25p.
NEVES, A. L. R. LACERDA, C. F. DE ., GUIMARÃES, F. V. A., HERNANDEZ, F. F. F., SILVA, F. B. DA., PRISCO, J. T., GHEYI, H. R. (2009). Acumulação de biomassa e extração de nutrientes por plantas de feijão-de-corda irrigadas com água salina em diferentes estádios de desenvolvimento. Revista Ciência Rural, v. 39, n. 03, p. 758-765.
OLIVEIRA, A. F., OLIVEIRA, F. R. A. DE., CAMPOS, M. DE S., OLIVEIRA, M. K. T. DE., MEDEIROS, J. F. DE., SILVA, O. M. DOS P. DA. (2010). Interação entre salinidade e fontes de nitrogênio no desenvolvimento inicial da cultura do girassol. Revista Brasileira Ciência Agrária, v. 05, n. 04, p. 479-484
OLIVEIRA, F. T. DE; HAFLE, O. M.; MENDONÇA, V.; MOREIRA, J. N.; PEREIRA JÚNIOR, E. B.; ROLIM, H. O. (2015). Respostas de porta-enxertos de goiabeira sob diferentes fontes e proporções de materiais orgânicos. Comunicata Scientiae, v.6, p.17-25.
SILVA, E.C., NOGUEIRA, R.J.M.C., ARAÚJO, F.P., MELO, N.F., AZEVEDO NETO, A.D. (2008). Physiological responses to salt stress in young umbu plants. Environmental and Experimental Botany, v.63, n.1-3, p.147-157.
SILVA, T.G.F.; ZOLNIER, S.; GROSSI, J.A.S.; BARBOSA, J.G.; MOURA, C.R.W.; MUNIZ, M.A. (2009). Crescimento do girassol ornamental cultivado em ambiente protegido sob diferentes níveis de condutividade elétrica de fertirrigação. Revista Ceres, v.56, n.5, p.602-610.
SOUZA, L. DE P.; NOBRE, R. G.; SILVA, E. M. DA; LIMA, G. S. DE; PINHEIRO, F. W. A.; ALMEIDA, L. L. DE S. (2016). Formation of ‘Crioula’ guava rootstock under saline water irrigation and nitrogen doses. Revista Brasileira de Engenharia Agrícola e Ambiental, v.20, p.739-745.
Tabela 1. Características físicas e químicas do substrato utilizado no experimento
Classificação textural |
Densidade aparente |
Porosidade total |
Matéria orgânica |
|
Complexo sortivo |
||||||||||||
P |
Ca2+ |
Mg2+ |
Na+ |
K+ |
|||||||||||||
|
g cm-3 |
% |
g kg-1 |
mg dm-3 |
--------- cmolc dm-3 -------- |
||||||||||||
Franco arenoso |
1,38 |
47,00 |
32 |
17 |
5,4 |
4,1 |
2,21 |
0,28 |
|||||||||
Extrato de saturação |
|||||||||||||||||
pHes |
CEes |
Ca2+ |
Mg2+ |
K+ |
Na+ |
Cl- |
SO42- |
CO32- |
HCO3- |
Saturação |
|||||||
dS m-1 |
--------------------------- mmolc dm-3 -------------------------- |
% |
|||||||||||||||
7,41 |
1,21 |
2,50 |
3,75 |
4,74 |
3,02 |
7,50 |
3,10 |
0,00 |
5,63 |
27,00 |
|||||||
pHes = pH do extrato de saturação do substrato; CEes = Condutividade elétrica do extrato de saturação do substrato a 25 ° C
-----
Tabela 2. Resumo da analise de variância para comprimento do ramo (CR), diâmetro do caule (DC),
diâmetro caule no ponto de enxertia (DCPE) e área foliar (AF) de mudas enxertadas de goiabeira
Fonte de variação |
GL |
Quadrado médio |
|||||||
CR |
DC |
DCPE |
AF |
||||||
80 |
100 |
80 |
100 |
80 |
100 |
80 |
100 |
||
Salinidades (S) |
4 |
17,97* |
60,87* |
0,08 ns |
0,46 * |
0,30 ns |
0,47 * |
4952,36** |
8730,78** |
Reg. Linear |
1 |
69,89* |
231,6* |
0,31 ns |
1,35* |
0,45 ns |
1,37* |
16194,9** |
32718,1** |
Reg. Quadrática |
1 |
1,83ns |
2,67 ns |
0,00 ns |
0,19 ns |
0,47 ns |
0,02 ns |
2747,22 ns |
2114,31 ns |
Doses de N (DN) |
3 |
38,46* |
63,66* |
0,08 ns |
0,16 ns |
0,48 ns |
0,58 * |
7480,00** |
6730,48** |
Reg. Linear |
1 |
100** |
178,8** |
0,23 ns |
0,23 ns |
0,45 ns |
1,43* |
20360,0** |
18438,3** |
Reg. Quadrática |
1 |
0,37ns |
0,70 ns |
0,00 ns |
0,17 ns |
1,00 ns |
0,20 ns |
1,14 ns |
48,95 ns |
Interação (S x DN) |
12 |
19,90ns |
15,50 ns |
0,17 ns |
0,33 ns |
0,39 ns |
0,41 ns |
1270,64 ns |
603,48 ns |
BLOCO |
3 |
16,08ns |
10,12 ns |
0,40 ns |
0,45 ns |
2,90 ns |
2,62** |
150,02 ns |
1021,42 ns |
CV (%) |
|
28,01 |
26,70 |
13,28 |
12,16 |
11,54 |
10,63 |
25,29 |
23,50 |
ns, **, * respectivamente não significativos, significativo a p ≤ 0,01 e p ≤ 0,05.
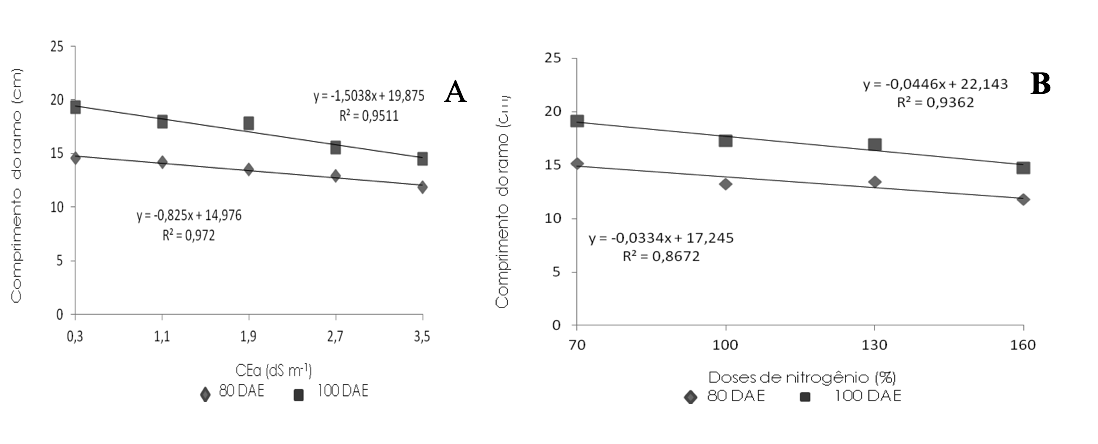
Figura 1. Comprimento do ramo – CR de mudas enxertadas de goiabeira em função da salinidade
da água de irrigação – CEa (A) e doses de nitrogênio (B) aos 80 e 100 dias após a enxertia.
-----

Figura 2. Diâmetro do caule – DC e diâmetro do caule no ponto de enxertia – DCPE de mudas enxertadas
de goiabeira em função da salinidade da água de irrigação – CEa (A) e doses de nitrogênio (B)aos 100 dias após a enxertia - DAE.
-----

Figura 3. Área foliar – AF de mudas enxertadas de goiabeira em função da salinidade da água de irrigação –
CEa (A) e doses de nitrogênio (B) aos 80 e 100 dias após a enxertia (DAE).
-----
Tabela 3 – Resumo da analise de variância para fitomassas fresca (FFPA) e seca da parte aérea (FSPA),
seca total (FST) e índice de qualidade de Dickson (IQD) aos 100 dias após a enxertia - DAE;
e taxa de crescimento absoluto (TCAaf) e relativo da área foliar (TCRaf) de
mudas enxertadas de goiabeira irrigada com águas salinizadas e sob
doses de nitrogênio no período de 50-100 DAE.
Fonte de variação |
GL |
Quadrado Médio |
|||||
FFPA |
FSPA |
FST |
TCAaf |
TCRaf |
IQD |
||
100 |
100 |
100 |
50 - 100 |
50 - 100 |
100 |
||
Salinidades (S) |
4 |
63,29** |
7,48** |
15,97** |
3,63** |
0,00016* |
0,52** |
Reg. Linear |
1 |
224,55** |
27,56** |
52,25** |
12,34** |
0,00032** |
1,72** |
Reg. Quadrática |
1 |
2,04 ns |
1,46 ns |
7,87 ns |
0,82 ns |
0,00002ns |
0,25* |
Doses de N (DN) |
3 |
22,83 * |
4,93* |
6,28 ns |
1,75* |
0,00001ns |
0,16ns |
Reg. Linear |
1 |
60,29* |
12,85* |
12,03 ns |
4,85** |
0,000034ns |
0,02ns |
Reg. Quadrática |
1 |
7,00 ns |
0,00 ns |
2,55 ns |
0,01ns |
0,000004ns |
0,25ns |
Interação (S x DN) |
12 |
13,52 ns |
2,75 ns |
6,45 ns |
0,75ns |
0,00011ns |
0,17** |
BLOCO |
3 |
6,54 ns |
3,96 ns |
6,27 ns |
1,84* |
0,00015ns |
0,23* |
CV (%) |
|
29,61 |
30,99 |
30,42 |
40,63 |
41,79 |
24,37 |
ns, **, * respectivamente não significativos, significativo a p ≤ 0,01 e p ≤ 0,05.
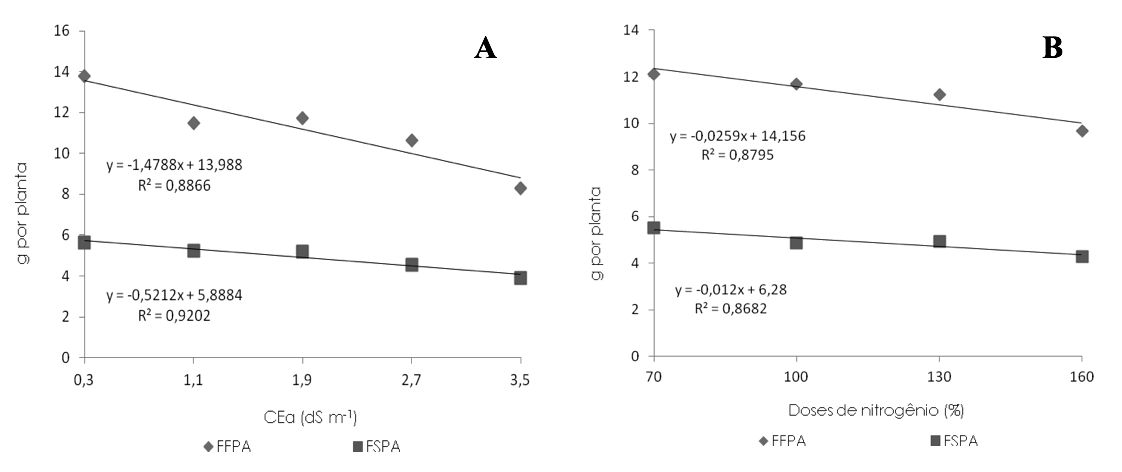
Figura 4. Fitomassas fresca (FFPA) e seca da parte aérea (FSPA) de mudas enxertadas de goiabeira aos 100 dias
após a enxertia – DAE, em função da salinidade da água de irrigação - CEa (A) e das doses de nitrogênio (B).
------

Figura 5. Fitomassa seca total – FST de mudas enxertadas
de goiabeira em função da salinidade da água de irrigação –
CEa aos 100 dias após a enxertia – DAE.
-----
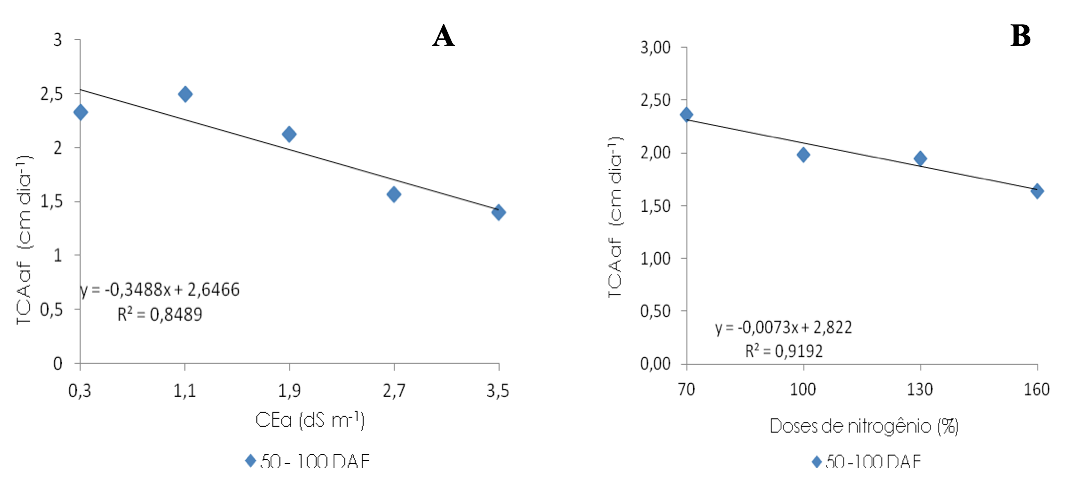
Figura 6. Taxa de crescimento absoluto da área foliar (TCAaf) de mudas enxertadas de goiabeira
em função da condutividade elétrica da água de irrigação – CEa (A) e doses de nitrogênio (B)
no intervalo de 50 à 100 dias após a enxertia – DAE.
-----

Figura 7. Taxa de crescimento relativo da área foliar (TCRaf) de mudas enxertadas de
goiabeira em função da salinidade da água de irrigação no intervalo de 50-100 dias após a enxertia – DAE.
-----

Figura 8. Índice que qualidade de Dickson – IQD de mudas enxertadas de goiabeira
em função da interação entre salinidade da água de irrigação e doses de nitrogênio aos 100 DAE .
1. Mestre Sistemas Agroindustrias, Universidade Federal de Campina Grande, Pombal- PB. E email: daniel-abrantes@hotmail.com
2. Prof. Doutor Adjunto III Universidade Federal de Campina Grande, Pombal- PB CCTA/ UAGRA/UFCG, Pombal, PB, e-mail: rgomesnobre@pq.cnpq.br
3. Doutorando Engenharia Agrícola (Irrigação e Drenagem)- (CTRN/ UFCG), Universidade Federal de Campina Grande, Campina Grande-PB, e-mail: engenheiropadua@hotmail.com
4. Prof. Doutor Instituto Federal de Educação Ciência e Tecnologia da Paraíba, Sousa-PB. e-mail: everaldomg2010@gmail.com
5. Prof. Doutor Universidade Federal de Campina Grande, Pombal- PB CCTA/ UAGRA/UFCG, Pombal, PB. e-mail: anielsonsantos@gmail.com
6. Universidade Federal de Campina Grande, Pombal- PB, Engenheiro Agrônomo, Pombal, PB. e-mail: fablo.ufcg09@gmail.com