

Vol. 38 (Nº 23) Año 2017. Pág. 12
Gabriel Sperandio MILAN 1; Daniela Soldatelli TREVISAN 2; Luciene EBERLE 3; Fernanda LAZZARI 4; Deonir De TONI 5
Recibido: 24/11/16 • Aprobado: 12/12/2016
5. Discusión de los Principales Resultados
RESUMEN: El mercado de la salud ha experimentado un proceso similar a lo que otros mercados en los últimos años. Junto a esto, hay la necesidad de la prevención y minimización de errores, principalmente acerca de la implantación de Sistemas de Garantía de Calidad (SGC). La evaluación y el reconocimiento de la calidad de los servicios de salud se obtienen a través de la Acreditación. En este estudio, uno de los primeros pasos para establecerse un SGC fue adquirir conocimiento de la sucesión de trabajo que habría por delante, destacándose: la redacción de documentos, el envolvimiento de empleados y el destino de recursos. Sin embargo, en el laboratorio la obtención a través del DICQ/SBAC ha proporcionado oportunidades de mejora y mantenimiento de excelencia en el servicio. Aún así, la adopción de un sistema de calidad no garantiza la ausencia de fallas, pero demostrará ser involucrado en el proceso, teniendo a su disposición una serie de recursos y normas que pueden ayudar en la corrección de las fallas. Además, la Acreditación es un instrumento importante de la competitividad en el escenario actual. |
ABSTRACT: The healthcare market has experienced a similar process that other markets in recent years. Allied to this, there is the need for prevention and minimization of errors, mainly with the implementation of Quality Management Systems (QMS). Assessment and recognition of the health services quality can be obtained by Accreditation. In study one of the first steps to establish a QMS environment was aware of the range of work that lay ahead, citing some aspects: drafting documents, employee engagement and resource allocation. In the laboratory, the accreditation obtained by DICQ/SBAC provided the opportunities for improvement and sustaining service excellence. But adoption of a quality system will not guarantee the absence of failures, but a laboratory that is involved in this process has at its disposal a number of resources and standards that can help in correcting faults. Moreover accreditation will be an important instrument of competitiveness in the current scenario. |
El concepto de calidad comenzó a tener gran realce debido al desarrollo tecnológico en las últimas décadas (Juran, De Feo, 2010; Vieira et al., 2011; Vieira, 2012). Además, Varios autores señalan que muchos factores pueden afectar la disposición de los clientes (pacientes) y su percepción de la calidad del servicio (Berry, Bendapudi, 2007) y, por lo tanto, si reenfocar la importancia de la comprensión de los diferentes aspectos de los servicios de salud (Gruber, Frugone, 2011).
En este contexto, los laboratorios pueden hacer uso de un sistema de control de calidad que, en un sentido amplio, puede asegurar un mejor rendimiento en cada una de las etapas de la operación (Mendes, 1998), comprendidas en preanalítica (por ejemplo: la preparación del paciente, el ayuno adecuado, y la recogida de muestras en el momento adecuado); analítica (en la ejecución real del examen); y postanalítica (errores de digitación, errores en la impresión y entrega de laudos).
En concordancia a esto, los Sistemas de Gestión de Calidad (SGC) son importantes para la gestión de negocios y, si aplicados adecuadamente, pueden contribuir a la mejora de las organizaciones de salud, haciéndolas más competitivas (Figueiredo, Pires, 2007). Conforme Gonçalo y Borges (2010), se define la gestión de los servicios como un proceso decisorio, lo que requiere la coordinación múltiple de actividades y la conducción de las personas, obteniendo y haciendo recursos disponibles de acuerdo a sus necesidades. En este sentido, la ocurre la comprobación de que un SGC se aplica correctamente y es eficaz en relación con la certificación o acreditación.
La certificación, de acuerdo con Vieira et al. (2011) atiesta que ciertos procesos, productos o servicios se realizan de acuerdo con los requisitos especificados, como por ejemplo la ISO (International Organization for Standardization). La acreditación es un procedimiento para la evaluación de los recursos institucionales; voluntario, periódico y reservado, que tiende a garantizar la calidad de la asistencia de las normas previamente aceptadas (Bittar, 2000, 2004), en otras palabras, tiene la intención de verificar la adecuación de los servicios que ofrecidos, además de cumplir los requisitos para la certificación (Vieira etal., 2011).
En las áreas de la salud, por ejemplo, la acreditación de la JCAHO (Joint Commission on Accreditation of Healthcare Organizations), de la Accreditation Canada, de la ONA (Organización Nacional de Acreditación) y los programas para la acreditación de laboratorios clínicos – PALC (Programa de Acreditación de Laboratorios Clínicos) de la Sociedad Brasileña de Patología Clínica y el DICQ Sistema Nacional de Acreditación da SBAC (Sociedad Brasileña de Análisis Clínicos). Podemos resaltar que el SGC del Laboratorio estudiado y analizado fue desarrollado de acuerdo con el Manual de Acreditación de Laboratorios Clínicos, preparado por DICQ, un Sistema Nacional de Acreditación, que orienta los laboratorios clínicos que tienen como objetivo obtener la acreditación de su sistema de calidad (SBAC, 2013).
Los requisitos de acreditación del DICQ se basan en: (i) las normas ISO aplicables específicamente a la gestión de calidad de los laboratorios (ABNT NBR 14.500 – Gestión de la Calidad en los Laboratorios Clínicos y ISO 15.189 – Medical Laboratories– Particular Requirements for Quality and Competence); (ii) ABNT/NBR 14785 – Laboratorio Clínico – requisitos de seguridad; (iii) ABNT/NBR 14501 – Glosario de términos para uso en Laboratorio Clínico y en el diagnóstico in vitro; (iv) RDC nº 302, de ANVISA – Agência Nacional de Vigilância Sanitária, que establece el Reglamento Técnico para el Funcionamiento de Laboratorios Clínicos; (v) Norma de Reglamentación NR-32 Seguridad y Salud en el trabajo de Servicios de Salud (publicada por: Portaria MTE nº 485 do Ministério do Trabalho e Emprego); (vi) RDC nº 306 de ANVISA – Gestión de Residuos de Servicios de Salud; (vii) Buenas Prácticas de Laboratorios Clínicos (BPLC); y (viii) en la aplicación de los conocimientos más actuales existentes en la técnica, la capacitación y la formación de profesionales y en la ejecución exacta de un sistema de control de calidad interno y externo, con el objetivo de permitir la emisión de laudos confiables, necesarios para el diagnóstico, tratamiento y acompañamiento de las enfermedades humanas (DICQ, 2013a; DICQ, 2013b).
Así que la búsqueda de la acreditación fue motivada principalmente por el aumento del nivel de calidad de los servicios y la ampliación del grado de seguridad ofrecido a los clientes o usuarios de los servicios, ya que los laboratorios clínicos tienen una responsabilidad importante en la decisión médica. En concordancia a esto, el progreso tecnológico en los laboratorios ha permitido la expansión del número y de los tipos de análisis; este es el aspecto principal que permite la implementación de conceptos modernos de calidad en laboratorios clínicos (Vieira etal., 2011; Berlitz, Haussen, 2005).
Por lo tanto, la búsqueda de la mejora continua requiere un análisis de los diferentes procesos que intervienen en la realización de exámenes de laboratorio, incluyendo los aspectos técnicos, organizativos y administrativos, así como la identificación de dificultades y limitaciones, y proponer oportunidades de mejora. La implementación del SGC hace surgir los indicadores de laboratorio, que permiten evaluar la eficacia y la eficiencia de las diferentes etapas de la ejecución de las exámenes, ocurriendo así menores tasas de error, aumento de productividad, satisfacción del cliente y de los médicos debido a la calidad del servicio prestado (Mendes, 1998; Vieira, 2012).
El laboratorio clínico corresponde a la estructura física para la realización de exámenes de laboratorio, a la práctica médica conocida como patología clínica, y más recientemente la medicina de laboratorio (Vieira, 2012). La principal actividad del laboratorio clínico es la evaluación de los espécimen biológicos por medio de pruebas de laboratorio, que tienen como finalidad contribuir con el diagnóstico, apartar las enfermedades, establecer el periodo de la patología y el pronóstico, acompañar de la eficacia terapéutica y verificar la presencia de factores de riesgo de daño a la salud humana (Mendes, 1998).
El médico cuando atiende un paciente, a través de anamnesis, obtiene los datos clínicos que pueden no ser suficientes para establecer el diagnóstico o para evaluar la etapa de la enfermedad. Así que en este momento comienza la relación a tríplice paciente-médico-laboratorio, cuyo objetivo es responder a las preguntas: ¿Existe la enfermedad? ¿Cuál? ¿En qué etapa? (Mendes, 1998).
La Figura 1 representa esquemáticamente la tríplice relación, mostrando las etapas del proceso de laboratorio, que es el objetivo de la fusión del sistema de calidad en la realización de exámenes de laboratorio.
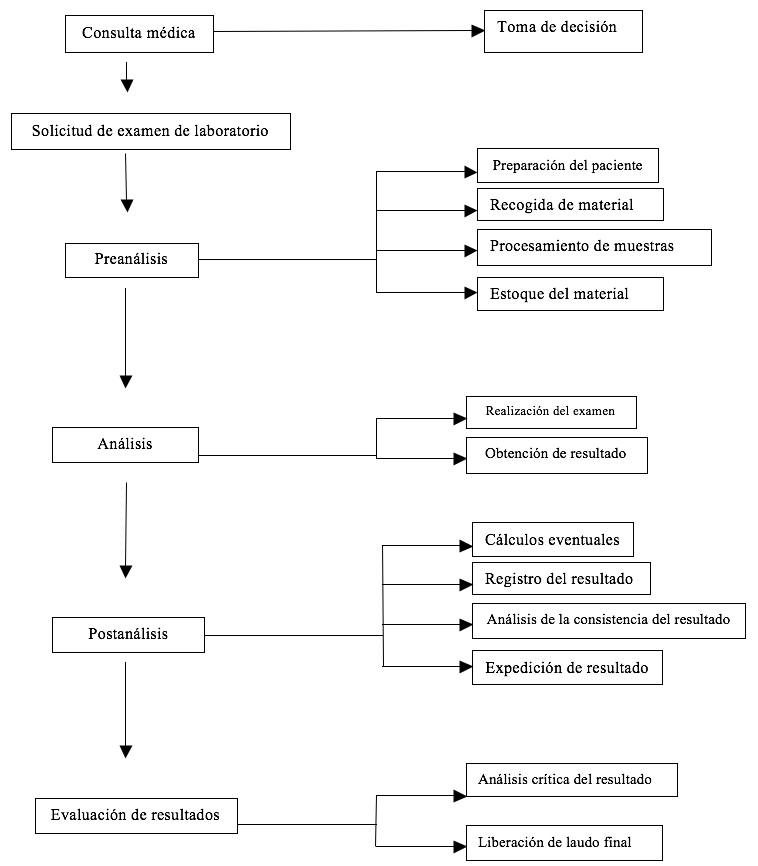
Figura 1 – Eventos de la relación médico-paciente-laboratorio
Fuente: Mendes (1998, p. 4).
Según Westgard y Darcy (2004), los resultados de los análisis de laboratorio son responsables de 65-75% de las informaciones que llevan el médico a tomar la decisión, entonces surgió la necesidad de incorporar conceptos de calidad en todas las etapas de la ejecución del examen de laboratorio (Westgard et al., 1991; Westgard, Darcy, 2004, Vieira, 2012).
Las tres etapas (preanalítica, analítica y postanalítica) de procesamiento de una muestra biológica contemplan la posibilidad de errores que afectan a la calidad y confiabilidad de los resultados (Carraro, Plebani, 2007). En la Figura 2 se muestran los elementos principales de cada fase, también se muestra la frecuencia de errores estimada en cada etapa:
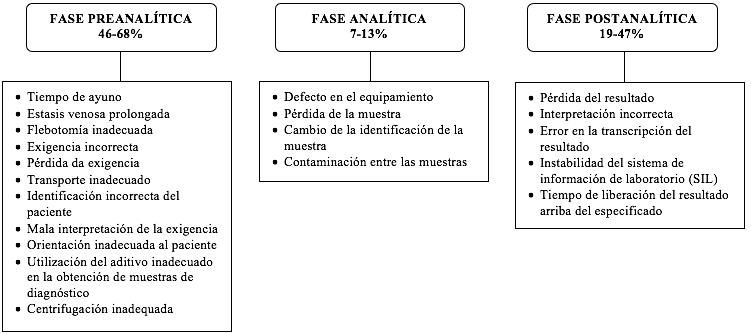
Figura 2 – Fuentes y frecuencia de error en el procesamiento de muestra para diagnóstico
Fuente: Adaptado de Lima-Oliveira et al. (2009).
En el área de la salud, la filosofía de calidad no difiere de la que aplican las industrias (Vieira, 2012; Han, Hyun, 2013). La creciente complejidad de los servicios de salud, impulsados por la demanda tecnológica y de nuevos conocimientos, más el aumento de la expectativa de vida y el mayor número de pacientes con enfermedades crónicas, está imponiendo cargas a los gastos en esta área. Así que el objetivo en la actualidad es proporcionar cuidado humano, con una alta productividad y bajo costo, y esto es lo que uno espera con programas de calidad (Bittar, 2000, 2004).
Gestión de calidad en los servicios de salud tiene dos áreas que afectan directamente a la satisfacción del cliente, y el campo de la técnica en cuanto a la precisión del diagnóstico y el campo de los procesos interpersonales que cubren la interacción entre el proveedor de servicios y clientes (Dagger, Sweeney, Johnson, 2011). Inclusive, el autor también señala que, en la actualidad, los requisitos de calidad se consideran atributo esencial para la supervivencia de las organizaciones en el mercado, con un énfasis en la satisfacción del cliente. Además, la percepción de la calidad en el cuidado de la salud es fundamental para el éxito de una organización de atención médica debido a su influencia en la satisfacción del cliente (paciente) y la rentabilidad del proveedor de servicios (Ramanujam, 2011).
Además, Fowdar (2013) afirma que la calidad de los servicios de salud se perciben en relación a la relación desarrollada con el carácter profesional de las especialidades de los servicios contratados y se consume y la ansiedad ligada a la resolución de problemas de salud, haciéndolos realizar un muy alto riesgo que pueda afectar los costes de cambiar de proveedores de servicios (Han, Hyun, 2013).
En la gestión de calidad de los laboratorios, los ensayos de aptitud son herramientas eficaces para evaluar el rendimiento de la fase de análisis (Lima-Oliveira et al., 2009) y son valiosas en el proceso de mejora de la calidad (PNCQ, 2013a, 2013b, 2013c). Las pruebas de competência son estudios entre laboratorios utilizados como herramientas de evaluación externa y de demostración de la confiabilidad de los resultados analíticos de laboratorio; también sirven para identificar las deficiencias y permitir la adopción de medidas correctivas o preventivas, uno de estos elementos es necesarios para la acreditación (INCQS, 2013). Por lo tanto, los procesos de control interno y externo, se deben combinar con un sistema de gestión comprometida con la calidad de las fases preanalítica y postanalítica, estos procesos permiten aumentar la confiabilidad de los resultados de laboratorio (Lima-Oliveira et al., 2009; Carraro, Plebani, 2007).
También se puede destacar que en los servicios de salud, la calidad técnica se refiere a los servicios clínicos y la exactitud de los diagnósticos y tratamientos (Metha, 2011). La calidad funcional se refiere a la forma de prestación de servicios y el servicio al paciente. Sin embargo, es importante tener en cuenta que el cliente es incapaz de evaluar la calidad técnica, debido a la necesidad de un conocimiento profundo de los servicios (D’Souza, Sequeira, 2012).
En Brasil, hay dos programas de ensayo de aptitud: el Programa de Excelencia para Laboratorios Clínicos (PELM) de la Sociedad Brasileña de Patología Clínica / Medicina de Laboratorio (SBPC / ML) y el Programa Nacional para el Control de la Calidad (PNCQ) de la SBAC (Lima-Oliveira et al., 2009), el último es actualmente el mayor proveedor de ensayos de aptitud del país (PNCQ, 2013a). Los laboratorios clínicos que participan voluntariamente en los programas que tienen como objetivo proporcionar subsidios para la implementación del control de calidad externa e interna, y así verificar la precisión mediante el control de la fase de análisis de las pruebas de laboratorio. Las otras fases que intervienen en el proceso de laboratorio no son evaluadas por estos programas, lo que las hace más vulnerables a los errores (Brasil, 2006; Feldman et al., 2005).
A partir de un sistema de control de calidad interno y externo bien implantado y consistente, las empresas pueden reclamar el reconocimiento de este sistema a través de la acreditación. Los elementos envueltos en la realización de pruebas de laboratorio son "elementos de control" que pueden ser medidos a través de indicadores de calidad, lo que demuestra la eficiencia y la confiabilidad del sistema de gestión de calidad. Los sistemas de acreditación permiten que los laboratorios sigan un camino hacia la mejora continua de la calidad, y de acuerdo con Nehme (2008) crean nuevas actividades para todos los profesionales del laboratorio, promueven las herramientas de gestión, y crean formas innovadoras de trabajo, que funcionan como herramientas para evaluar las habilidades de los procesos y personas.
La SBAC – Sociedad Brasileña de Análisis Clínicos es una organización de carácter profesional y científico sin fines de lucro, creada con el objetivo principal de desarrollar la especialidad de Análisis Clínicos y de Laboratorios Clínicos (SBAC, 2013). En 1997, SBAC, preocupada por la calidad de los laboratorios clínicos, creó su Departamento de Inspección y Acreditación de la Calidad (DICQ), con el objetivo de desarrollar, implementar y poner en funcionamiento la Acreditación de Laboratorios Clínicos y organizaciones que prestan servicios de salud, dentro de los estándares de calidad nacional e internacional.
Como una evolución en el ámbito de la calidad, DICQ / SBAC, que era un departamento, amplió sus fronteras en 2004 y formó el Sistema Nacional de Acreditación, entidad integrada con la Sociedad Brasileña de Análisis Clínicos en forma de patrocinio, manteniendo la sigla como DICQ debido a la credibilidad lograda en su área de actuación (DICQ, 2013a). El DICQ es una Institución Certificadora de Acreditación (Instituição Acreditadora Credenciadora –IAC) por ONA (Organización Nacional de Acreditación), una empresa vinculada al Sistema Brasileño de Acreditación (PNQC, 2013b, 2013c).
El DICQ es una norma específica y bien amplia, y tiene exigencias que cubren todas las áreas críticas del laboratorio clínico. Entiende que la implantación de un sistema de gestión de calidad en los laboratorios debe seguir una dinámica y aplicarse gradualmente en la empresa. Los requisitos establecidos en el manual de DICQ se dividen en categorías y definen requisitos específicos para (DICQ, 2013b, 2013c):
El trabajo se desarrolló en un laboratorio de tamaño medio ubicado en Serra Gaúcha. Fundado en 1954 por una farmacéutica-bioquímica, es una institución privada y desde su inauguración, el laboratorio pasó por diferentes fases de expansión resultantes del aumento gradual de la demanda. Cuando comenzó a operar, realizaba cerca de 10 exámenes por día y tenía solamente un empleado. Actualmente, lleva a cabo más de 650 exámenes por día en sus diversos sectores – hematología, bioquímica, microbiología y análisis de orina, ejecutados por sus 16 empleados. Además, cuenta con el apoyo otros laboratorios para ejecución de exámenes más complejos, y debido a esta externalización, ha podido ampliar su oferta de servicios.
Posee laboratorio matriz y una sucursal que atiende a un hospital de la ciudad y a los clientes externos, con una demanda de 1.100 pacientes al mes. El perfil de los clientes del hospital es constituido de pacientes del Sistema Único de Salud (SUS), los usuarios de los planes de salud y pacientes particulares, 40%, 50% y 10% respectivamente. Como el perfil de los clientes externos se compone de los usuarios de los planes de salud y pacientes particulares, 80 y 20% respectivamente.
El laboratorio fue elegido como objeto de estudio por los siguientes motivos: (i) tiene preocupación por la calidad de los servicios prestados; (ii) está en constante actualización tecnológica; (iii) tiene un compromiso con la mejora continua del trabajo en equipo; y (iv) es mi lugar de trabajo desde 2006.
Este trabajo tiene como principal objetivo describir y evaluar la experiencia adquirida en el desarrollo e implementación de un proceso de calidad del Sistema de Gestão da Qualidade do Programa de Acreditação de Laboratórios Clínicos DICQ/SBAC, a través de un análisis retrospectivo y prospectivo.
Se identificaron los siguientes objetivos específicos para el trabajo: (i) describir el proceso de implementación del SGQ en el Laboratorio estudiado, en todas sus etapas, fundamentado en las normas de DICQ-SBAC; (ii) analizar las principales dificultades encontradas; (iii) presentar el conjunto de indicadores de rendimiento implementado; (iv) y discutir los principales resultados.
Con los años el conocimiento de la gama de trabajo y las dificultades que se enfrentan para implementar de manera efectiva y poco a poco el sistema de calidad ha desarrollado. La investigación realizada es de carácter exploratorio, y es operacionalizado principalmente a través de la observación directa y por la investigación documental a través de análisis de los informes y otros documentos disponibles (Malhotra et al., 2012; Gibbs, 2008; Bernard, Ryan, 2010; Boeije, 2010; Scott, Garner, 2013).
Según Hennink et al. (2011) y Remler y Van Ryzin (2011), la investigación cualitativa, exploratoria, proporciona un mejor conocimiento y comprensión del contexto de la investigación, y tiene como objetivo identificar los cursos alternativos de acción, estableciendo relaciones clave que deben examinarse, e identificación de las prioridades para la investigación relacionada.
Este tipo de abordaje se basa en pequeñas muestras que no son representativas, donde los datos no se analizan estadísticamente, prestándose a colaborar en el perfeccionamiento de los conceptos, el conocimiento de las reacciones generales y explorar nuevas áreas de oportunidad (Hellebusch, 2000; Scott, Garner, 2013). Aún así, el desarrollo de un estudio de investigación cualitativa implica un corte temporal-espacial determinado fenómeno por el investigador (Gibbs, 2008) y todavía trae como contribución a los procesos de trabajo una mezcla de naturaleza racional e intuitivo que puede contribuir a una mejor comprensión de los fenómenos (Pope, Mays, 1995; Bardin, 2004).
Para el proceso de análisis e interpretación de los datos recogidos, se utilizó el análisis de contenido constituido en tres etapas: preanálisis; exploración de materiales y utilización de los resultados, inferencia e interpretación (Bardin, 2006). Para obtener una mayor validez de la investigación (Gibbs, 2008; Hennink et al., 2011), con el objetivo de obtener explicaciones más precisas y tener una mejor comprensión de las explicaciones de contexto.
Se utilizó en este estudio, la investigación documental, que fue realizada a partir de datos proporcionados por el laboratorio, recogidos entre 2006 y 2012. La investigación documental utiliza las fuentes más diversas y dispares, sin tratamiento analítico, tales como: tablas estadísticas, informes, documentos oficiales, cartas, fotografías, informes de empresa, etc. (Gibbs, 2008; Hennink et al., 2011; Remler, Van Ryzin, 2011; Malhotra et al., 2012).
Este tipo de investigación tiene como objetivo proporcionar una mayor familiaridad con el problema, con el fin de hacerlo más explícito o construir hipótesis, que pueden incluir: revisión de la literatura y análisis de ejemplos que animan a la comprensión. En función de esto, esta investigación puede ser clasificada como una investigación de la literatura y estudio de caso (Gibbs, 2008; Yin, 2005). Se utilizó la literatura para saber lo que ya se había publicado en esta categoría sobre el tema a través de libros, artículos de revistas y sitios web. El estudio de caso es un método ampliamente utilizado en las ciencias biomédicas y sociales (Yin, 2005). En este caso, el estudio se centró en una institución: laboratorio de análisis clínicos y en un programa, el DICQ/SBAC que da la acreditación para servicios de salud.
Los datos analizados en este estudio fueron recogidos entre 2006 - 2013, envolviendo las distintas fases de implantación del Sistema de Gestión de la Calidad del laboratorio estudiado, desde la planificación, hasta el proceso de acreditación y sus implicaciones.
En relación al proyecto de implementar las reglas de DICQ en el laboratorio, se pueden citar algunos puntos relevantes:
En este contexto, el jefe del laboratorio siempre ha tenido en cuenta para el seguimiento, la implementación del sistema de calidad utilizando documentos y directrices proporcionadas por el proveedor de ensayos de aptitud PNCQ. El PNCQ proporciona para facilitar la aplicación de del Sistema de Gestión de Calidad de Laboratorios Clínicos, el software PNCQ Gestor, una herramienta de fácil operación que ayuda al laboratorio para desarrollar, organizar y controlar toda la documentación de calidad (PNCQ, 2013b). Desde el curso “PNCQ Gestor”, realizado en 2010 por las bioquímicas del laboratorio, hubo la posibilidad de estructurar mejor el sistema de calidad que permite mejoras en la preparación, organización y control de toda la documentación de la calidad, y adecuación a los requisitos del Sistema Nacional de Acreditación – DICQ.
Después del curso, los documentos de calidad que se llamaban “POPs” (Procedimentos Operacionais Padrão / Procedimientos Operativos Estándar), recibieron un nuevo nombre: “PQs” (Procedimentos da Qualidade / Procedimientos para la Calidad). Todos los documentos de calidad fueron rehechos por el modelo hipotético propuesto por el software, recibiendo nuevos encabezados y pies de página, de acuerdo con el modelo propuesto por el PNCQ Gestor. Vale la pena mencionar aquí que todos los empleados fueron notificados de la decisión de los directores de implementar el sistema de gestión de calidad.
Además, también se prepararon nuevos documentos de la calidad como:
Con esta reestructuración, una de las bioquímicas asumió la responsabilidad de la gestión del sistema de calidad y habla en nombre del Laboratorio Clínico ante el DICQ (requisito 1.1.7 del Manual DICQ). Después de la etapa de desarrollo y adaptación a la realidad de laboratorio y a los documentos sugeridas por el software PNCQ Gestor y, la adecuación física de los equipamientos, se realizó la primera auditoría interna, siguiendo la norma propuesta por PQ14 – Auditoría Interna de Calidad, que sigue a los requisitos de RDC 302/2005 de ANVISA y los requisitos de DICQ. Desde esta auditoria, no fue posible empezar los procedimientos para hacer frente a los requisitos “no conforme” detectados. Varios cambios ocurrieron en el laboratorio, las principales se sucedieran en la gestión de calidad, en el sector de recepción/colecta, área técnica, espacio físico, recursos humanos y documentación. Todo el SGQ se describe en el Manual de Calidad, que define por escrito toda la política, los objetivos y los procedimientos de laboratorio, basándose en los requisitos contenidos en el Manual para la Acreditación de DICQ/SBAC.
Entre 2009 y 2010 se hizo una reforma el laboratorio filial con el objetivo de lograr la aprobación del nuevo plan y el layout del laboratorio con el Departamento de Salud del Estado, para obtener el permiso sanitario (requisito 1.1.8). Esta reforma incluyó la reestructuración las áreas: técnica, colecta, limpia y sucia, la selección, de los roperos, cocina e incluso el depósito de los productos de limpieza. Entre los años 2012 y 2013 fue la matriz del laboratorio que experimentó una renovación total con el mismo propósito de regularización a través del órgano de Vigilancia Sanitario local y la obtención de la licencia, también atendiendo a una inconformidad de la primera auditoría externa, que exigió una sala de espera mayor y más cómoda para los clientes.
En 2011 hubo la consolidación de los documentos de calidad, y debido al aumento de la demanda, hubo la necesidad de adquirir nuevos equipamientos y la modernización de algunas áreas. El año de 2013 se realizó una nueva auditoría interna, y se constató (citando las inconformidades más significativas) la falta de calibración de algunos equipamientos, la necesidad de adaptarse a algunas listas, como las de los equipamientos y de laboratorios de apoyo, la preparación de un libro para registrar las inconformidades, acciones correctivas, y la falta de aplicación de los indicadores de proceso.
Después de este período de notificación de documentos, entrenamiento de los empleados y la concientización acerca de la responsabilidad en las tareas realizadas en el laboratorio, en marzo de 2012 se programó la primera auditoría externa, que duró dos días y fue realizada por un auditor principal. El auditor explicó en la reunión final de la Auditoría que el proceso requiere que los auditores adopten una posición a favor o en contra de la acreditación, mediante la observación de evidencias objetivas de conformidad. Después de unos 15 días, se envió el informe de la auditoría externa conteniendo las inconformidades detectadas y la declaración de que el auditor recomienda la acreditación del laboratorio después de resueltas las inconformidades.
La recomendación es mucho más importante que la evidencia de un Sistema de Calidad implementado y funcionando, esta recomendación demuestra que el equipo sabe enfrentar desafíos, que, aun con limitaciones, obtuvieron éxito en el proceso de acreditación. A principios de mayo de 2012, el Sistema Nacional de Acreditación – DICQ revisó las acciones correctivas tomadas y decidió conceder la acreditación para el Laboratorio.
Durante el año 2012, después de obtener la acreditación, el desafío era mantener y mejorar continuamente el SGQ, que resultó ser más difícil de lo que el proceso de implementación. Eso ocurre porque cuando uno alcanza el éxito con los objetivos, las personas pueden quedarse más tranquilas y acomodadas. Pero se mantuvo el foco para el SGQ fuera cada vez más insertado en las rutinas de trabajo. Así, desde la obtención de la acreditación, el laboratorio continuó con auditorías internas y comenzó a implantar los indicadores de resultados con mayor precisión.
En marzo de 2013, el laboratorio fue objeto de nueva auditoría externa, y fue necesario evidenciar las mejoras en el SGQ implementado y acreditado en 2012. Con un SGQ considerado más maduro por el auditor líder, después de resueltas las inconformidades identificados en el informe, se obtuvo de nuevo el certificado de acreditación.
Cada vez que un nuevo proceso es implementado en una empresa, a pesar de un planeamiento previo, surgen algunas dificultades, y estas pueden ser utilizadas como una oportunidad para el aprendizaje, para el crecimiento profesional y para la mejora del servicio. Se han encontrado varias dificultades en el proceso de implementación y mantenimiento del SGQ en el laboratorio estudiado; aquí van a ser citadas las dificultades más relevantes e impactantes de alguna manera en el proceso.
Hubo fallas en el desarrollo del proceso, lo que resultó en atrasos en el cronograma de implantación. La causa principal de eso fue la falta de preparación para la gestión del proyecto, ya que la gente que comenzó a organizar los procedimientos fueron los bioquímicos que trabajan en el laboratorio. Ellos no tenían el conocimiento formal de técnicas de gestión, y esto fue seguido inconscientemente. Sabían a dónde querían llegar, pero no había un plan, todo ocurría instintivamente. La mejora de la gestión en el área de calidad se produjo después de un curso ejecutado en 2010, por el equipo de bioquímica, y este curso les ayudó en la capacitación para gestión de auditorías internas, y por medio de software PNCQ-Gestor que permitió una mejor organización de los documentos, y la preparación de muchos otros que eran esenciales para la obtención de la acreditación.
La implementación del SGQ comenzó desde la parte superior hasta la base, ya que los jefes estaban muy motivados, pero, en contrapartida, fue difícil concientizar a todos los funcionarios acerca del proceso que se iniciaba. Ellos buscaron crear conciencia de los empleados a través de la transmisión del conocimiento (educación / formación), la búsqueda de habilidades, superación de resistencias, la internalización de los nuevos conceptos a la conquista del nuevo paradigma – la visión del proceso para comprobar la calidad y la excelencia en el servicio.
Una de las tareas más difíciles y exigentes en todo el proceso de acreditación fue la preparación de toda la parte documental, como manuales, registros y procedimientos escritos. Inicialmente la orientación era insuficiente en la preparación de documentos de calidad, y esto obstaculizó la fase de implantación. Pero después de buscar conocimiento en el área de gestión a través de cursos, el proceso se pudo ver con más claridad. La implementación fue realizada y monitoreada con la evaluación de los puntos fuertes y débiles, así como la formación y orientación de las personas que demuestren interés continuo en la calidad de la empresa.
Los indicadores de desempeño pueden ser definidos como una información cualitativa o cuantitativa, asociado a un evento, proceso o resultado. Además, es posible evaluar los cambios durante el tiempo y verificar o establecer metas o utilizarlo para tomar decisiones o elecciones (Carraro, Plebani, 2007; Plebani, 2007, 2009). Indicadores de laboratorio, según Ricós et al. (2004), son las especificaciones de calidad, pues el desempeño de un proceso es considerado satisfactorio si esté en los límites establecidos por los indicadores, cuyo objetivo no es proporcionar una respuesta, sino indicar posibles problemas que requieren acciones preventivas.
Los indicadores de desempeño implementadas por el laboratorio estudiado fueron descritos en un procedimiento de calidad, sugerido por el software PNCQ-Gestor. Se estima que la mayoría de los errores se concentran en la fase pre-analítica (Lima-Oliveira et al, 2009), en el laboratorio estudiado, uno de los indicadores implementados fue el "índice de recolectas", que está asociado con esta fase. En relación con este indicador hay varios defectos que pueden estar relacionados con: (i) deficiencias en la colecta - colección en tubo equivocado, hemólisis, muestra recogida incorrectamente; (ii) la identificación errónea – error en el registro del paciente o en los exámenes; y (iii) los problemas con transporte de muestras (Procedimiento de Calidad 19, en el año de 2012).
En el laboratorio se obtuvieron los siguientes números de muestras que necesitaron recoleta (Figura 3):
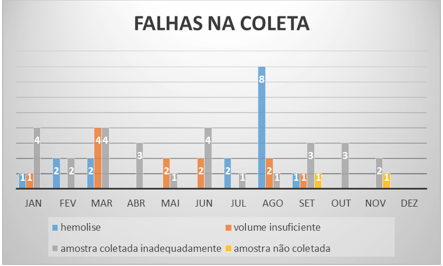
Figura 3 – Fallas en colectas (falhas na coleta) – 2012
Fuente: Laboratorio de Análisis Clínicos.
Se puede observar la identificación equivocada de las muestras sólo en los meses de marzo, abril, agosto y septiembre. La Figura 4 demuestra que hubo pocos casos de catastros erróneos en el 2012, sólo 8.
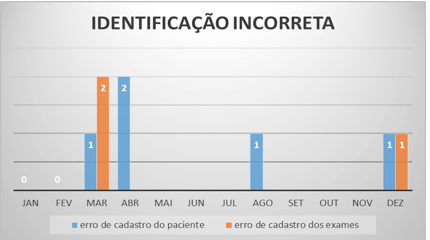
Figura 4 – Identificación de muestras incorrectas (identificação incorreta) – 2012
Fuente: Laboratorio de Análisis Clínicos.
El problema con el transporte de muestras está representado por la pérdida de muestras en el laboratorio, lo que significa que la muestra fue recibida en el laboratorio, pero nunca fue ejecutada. La pérdida de las muestras por el laboratorio de apoyo se produjo en junio, julio y diciembre (Figura 5).
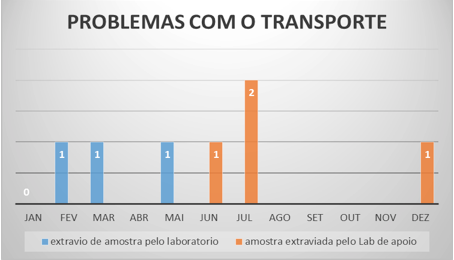
Figura 5 – Problemas com el transporte (problemas com o transporte) – 2012
Fuente: Laboratorio de Análisis Clínicos.
La fase de análisis es la fase de la aplicación de las pruebas de laboratorio, que puede ser controlada por el control interno de calidad (CIQ) y por los ensayos de aptitud o control externo de calidad (CEQ) (Vieira et al., 2011). CIQ y CEQ son herramientas utilizadas en el laboratorio para asegurar los servicios, más específicamente, el proceso de la realización de las pruebas (Berlitz, Haussen, 2005). Fue implementado en el laboratorio estudiado un indicador que remite a esta fase, el “porcentaje de aciertos en el CEQ”, calculados por el proveedor de ensayos de aptitud. Se obtuvieron los siguientes porcentajes (Figura 6):
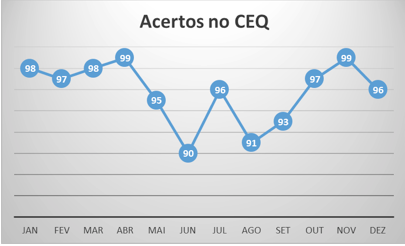
Figura 6 – Porcentaje de asertos en el CEQ (acertos no CEQ) – PNCQ 2012
Fuente: PNCQ.
Según Plebani (2007), la fase posterior de análisis, a su vez, envuelve los procesos de validación y liberación de laudos y termina después de que el médico recibe el laudo final, seguido de la interpretación y la toma de decisiones basado en el resultado comunicado. Los errores frecuentes asociados con este paso se deben a defectos en la liberación de los resultados, debido a errores en la transcripción o digitación, o no cumplimiento del plazo límite (Vieira et al., 2011). Se intentó aplicar el indicador “atraso en el plazo de entrega” asociado con la fase postanalítica, pero no hubo adhesión de recepción, entonces no hubo generación de datos para confección de un indicador, y eso puede ser un indicador de la resistencia de las personas en la adhesión del SGQ.
Los indicadores de laboratorio ayudan al proceso de realización de un examen, pero no hay consenso sobre los mejores indicadores para las diferentes fases del proceso de ejecución de examen, así como sus respectivos límites de aceptabilidad; debido a la gran variabilidad entre laboratorios (Vieira et al., 2011; Figueiredo, Pires, 2007; Bittar, 2004).
Desde el comienzo en 2006, cuando se empezó a diseñar la implementación de la calidad en el laboratorio, hubo una preocupación constante con la mejora de los servicios, de los procesos y de todos los elementos que se relacionan con la búsqueda de la excelencia en una organización.
La nueva realidad del mercado hizo posible que las organizaciones despierten un proceso de transformación continua (Nehme, 2008; Ramanujam, 2011). En función de esto, se produjo un cambio muy grande en el laboratorio estudiado, y eso porque calidad implica procesos de y mejora continua de la calidad. Para que el sistema sea estructurado y adaptado, se crearon nuevas condiciones y perspectivas sobre: el aprendizaje de las personas, sobre los procesos y los indicadores y la planificación del presupuesto.
Sobre las personas que trabajan en el laboratorio estudiado, hubo un reconocimiento de la importancia del proceso de implantación de calidad, lo que generó la motivación del grupo. Pero uno de los mayores desafíos enfrentados después de obtención de la acreditación, fue continuar y mantener el sistema que es muy amplio y requiere una vigilancia constante.
Por eso se instituyó reuniones mensuales con el grupo de funcionarios, siempre buscando el compromiso y la responsabilidad de las personas en la institución y el SGQ. El objetivo fue también identificar a las personas que necesitan entrenamiento y las que son resistentes al cambio de paradigmas para que no haya una ruptura en los enlaces que interconectan el SGQ. Con esto, estamos logrando una optimización de funciones, una imagen mejorada en el servicio interno y externo y una mejor interrelación. Por último, el éxito de una organización depende cada vez más de los conocimientos, habilidades, actitudes, creatividad y motivación de la fuerza de trabajo que contribuyen al logro de los objetivos deseados (Nehme, 2008).
Los tomadores de decisiones deben comprender la emergencia, el crecimiento y la difusión de tecnologías competitivas para anticipar cuando las nuevas tecnologías reemplazan las antiguas, buscando incorporar informaciones al proceso de gestión de la tecnología y de sus operaciones (Nehme, 2008; Fitzsimmons y Fitzsimmons, 2010).
En esta premisa, la modernización tecnológica de los equipamientos fue el resultado de todo el proceso de implantación de la calidad, así como la gestión de mantenimiento de los equipamientos y control de calibraciones. En 2010 fue adquirido un contador hematológico de cinco partes, que proporcionó un aumento de la productividad. Siguiendo la línea de modernización de los equipamientos, en 2011 el sector adquiere un equipamiento de hematología para back-up, y el sector bioquímico adquirió un electrodo ion selectivo, para reemplazar el fotómetro de llama, para la determinación de sodio y potasio.
Todavía en 2011, la gestión de los equipamientos comenzó a crecer, entonces fueron establecidos cronogramas de mantenimiento preventivo y calibración de los equipamientos, y esto interfirió directamente en la calidad del servicio. Todos estos esfuerzos produjeron una mejora en la ejecución de los exámenes, lo que reforzó el compromiso con la calidad en el servicio solicitado a través de la implementación del SGQ.
Los indicadores aún tienen que ganar en solidez en el laboratorio estudiado, resaltándose que la participación de todos los empleados es muy importante. Se puede observar que los colaboradores tienen dificultad para constatar reportar sus errores, que en última instancia, distorsiona los indicadores. Con un mejor acompañamiento de los indicadores se puede comprobar las necesidades, la contratación de nuevos empleados, la morosidad y, finalmente, la posibilidad de mejorar los procesos involucrados en el SGQ, implementar los objetivos de desempeño y mejorías.
Cada centro de salud cuenta con un proyecto de educación/preparación para la obtención de la acreditación. El costo será determinado por el tamaño y la complejidad de cada institución. En el laboratorio estudiado inicialmente se produjo un aumento significativo en el costo, alrededor del 20%, porque la aplicación de los recursos en las personas y en los procesos se hizo constante.
Con la implementación del SGQ, nuevas rutinas fueron incorporadas en los procesos de laboratorio. El control de calidad interno ganó más fuerza, lo que generó demanda de más recursos financieros en sueros controles, reactivos y equipamientos. El CEQ también requirió más recursos, porque en el programa fueron incorporados ensayos que previamente no fueron contemplados en el programa contratado. También se incrementó el número de empleados, por lo menos 3 empleados fueron contratados debido a la mayor carga de trabajo generada por el SGG. El SIL también generó costos, para la compra de nuevas computadoras e impresoras y también debido al programa que cumple las normas de trazabilidad de las muestras para el diagnóstico, desde de la colecta a la liberación del laudo.
Con la maduración del SGC hay la pretensión de alinear la calidad con los costos, siempre con enfoque en la satisfacción del cliente y en la salud financiera de la organización. Por supuesto, en un laboratorio donde se implementa un proyecto de calidad, hay que tener en cuenta los costos de “no calidad” (Juran, De Feo, 2010). De acuerdo con Berlitz y Haussen (2005), estos costos representan retrabajo, errores o defectos en los productos detectados después de su ejecución, y sin embargo, la insatisfacción del cliente con el producto de baja calidad, donde la optimización del sistema de control de calidad puede proporcionar efectos importantes para reducir los costos de la “no calidad”.
Los costos de la “no calidad” consumen recursos que podrían y deberían ser aplicadas con ganancias significativas en la calidad. Hoy en día la demanda de calidad en la adquisición de productos y servicios es cada vez más una imposición de la sociedad, transformando la calidad uno de los principales aliados y uno de los mejores y más eficaces factores de diferenciación (Juran, De Feo, 2010; Nehme, 2008, Westgard et al., 1991; Westgard, Darcy, 2004).
Actualmente no se puede dejar de pensar en la implementación de un sistema de calidad sin buscar reconocimiento de este por una autoridad competente. Al iniciar un programa de calidad, primeramente el programa se basa en la educación continuada y en el control, evolucionando hacia un sistema capaz de analizar la organización como un sistema complejo que es, sobre todo, cuando la cultura de la organización está envuelta (Nehme, 2008).
Por lo tanto, la calidad de los servicios de salud se percibe en relación con las experiencias de los clientes en relación con las dimensiones específicas como la conveniencia de una comunicación clara y precisa con los pacientes, la comodidad proporcionada por la estructura física del laboratorio, la exactitud de los resultados de los exámenes y la atención despendida con los pacientes y sus familias (Metha, 2011; RDC, 2005; Gonçalo, Borges, 2010).
El laboratorio estudiado ha trabajado en la búsqueda continua de la mejora de la calidad, la formación profesional y la excelencia en los servicios. De acuerdo con Nehme (2008), la exitosa implementación del SGQ dependerá tanto de sus recursos como de dos elementos fundamentales: el capital intelectual del laboratorio y de la cultura de la calidad. Esta cultura es esencial para que pueda alcanzar los objetivos propuestos, a través de la estandarización de los hábitos, creencias y conductas en el laboratorio, relacionadas con la calidad.
Por lo tanto, hay dos maneras de ver un programa de calidad. Al principio, la calidad siempre será vista como un costo impuesto por otro. Además, será vista como un desafío a alcanzar de la manera más exacta, como una opción. De un lado hay los. Al otro lado hay de las oportunidades estratégicas proporcionadas por sistemas que reflejan la mejora y el control (Nehme, 2008; Juran, De Feo, 2010). Lo que hace los laboratorios realmente diferentes de otros laboratorios es el Sistema de Gestión de la Calidad, que cumple satisfactoriamente con sus clientes y las normas impuestas por la ley y por el mercado.
Con este fin, las recomendaciones de Piva et al. (2007) hace hincapié en la importancia de las evaluaciones positivas de la calidad de los servicios, si ninguna intención de renovación de contratos en una perspectiva de futuro, cuando la percepción de los clientes es satisfactoria en relación con los resultados clínicos y el proveedor de servicio en sí, es decir, si se percibe la satisfacción general con el proveedor de cuidados de la salud.
La adopción de un sistema de calidad no garantiza la ausencia de fallas, pero un laboratorio que está envuelto en el proceso tiene a su disposición una serie de recursos y normas que pueden ayudar en la corrección de las fallas. Además, la acreditación del laboratorio puede proporcionar oportunidades de mejora, la sustentación de la excelencia del servicio y será un instrumento importante de la competitividad en el escenario actual.
Bardin, L. (2006); Análise de conteúdo, Lisboa, Edições 70.
Berlitz, A. B.; Haussen, M. L. (2005); “Seis sigma no laboratório clínico: impacto na gestão de performance analítica nos processos técnicos”, Jornal Brasileiro de Patologia Médica e Laboratorial, 41(5), 301-312.
Bernard, H. R.; Ryan, G. W. (2010); Analyzing qualitative data: systematic approaches, Thousand Oaks, Sage Publications.
Berry, L.; Bendapudi N. (2007); “Health Care: a fertile Field for service research”, Journal of Service Research, v. 10, n. 2, p. 111-122.
Bittar, O. J. N. V. (2000); “Gestão de processos e certificação para qualidade em saúde”, Revista Associação Medica Brasileira, 46(1), 357-363.
Bittar, O. J. N. V. (2004); “Indicadores de qualidade e quantidade em saúde – parte II”, Revista Administração em Saúde, 6(22), 21-28.
Boeije, H. (2010); Analysis in qualitative research, Thousand Oaks, Sage Publications.
Brasil. (2006); Seleção, uso e interpretação de programas de ensaios de proficiência (EP) por laboratórios, Brasília, Ministério da Saúde.
Carraro, P.; Plebani, M. (2007); “Errors in a stat laboratory: types and frequencies 10 years later”, Clinical Chemistry, 53, 1.338-1.342.
DICQ – Sistema Nacional de Acreditação. (2013a); Manual para acreditação do sistema de gestão da qualidade de laboratórios clínicos, 6. ed., Rio de Janeiro, SBAC.
Dagger, T. S.; Sweeney, J. C.; Johnson, L. W. (2007); “A hierarchical model of health service quality: scale development and investigation of an integrated model”, Journal of Service Research, 10(2), 123-142.
DICQ – Sistema Nacional de Acreditação (2013b); Regulamento do DICQ. Disponible en: www.dicq.org.br. Asesado en: 30 mar. 2013.
D’Souza, S. C.; Sequeira, A. H. (2012); “Measuring the customer-perceived service quality in health care organization: a case study”, Journal of Health Management, 14(1), 27-41.
Feldman, L. B.; Gatto, M. A. F.; Cunha, I. C. K. O. (2005); “História da evolução da qualidade hospitalar: dos padrões a acreditação”, Acta Paulista de Enfermagem, 18(2), 213-219.
Figueiredo, A. C.; Pires, M. B. (2007); Um sistema de gestão da qualidade:a acreditação de um laboratório de análises clínicas, In: XXVII Encontro Nacional de Engenharia de Produção, Anais... Foz do Iguaçu, Abepro.
Fitzsimmons, J. A.; Fitzsimmons, M. J. (2010); Administração de serviços: operações, estratégia e tecnologia da informação, 6. ed., Porto Alegre, Bookman.
Fowdar, R. R. R. (2013); “Assessing the influence of switching barriers on patients’ expectations and tolerance zone”, International Journal of Health Care Quality Assurance, 26(2), 226-249.
Gibbs, G. (2008); Analyzing qualitative data, Thousand Oaks, Sage Publications.
Gonçalo, C. R.; Borges, M. L. (2010); “Healthcare services based on knowledge structure”, Journal of Health Management, 12(4), 553-572.
Gruber, T.; Frugone, F. (2011); “Uncovering the desired qualities and behaviours of general practitioners (GPs) during medical (service recovery) encounters”, Journal of Service Management, 22(4), 491-521.
Han, H.; Hyun, S. S. (2013); “Image congruence and relationship quality in predicting switching intention: consyicuousness of product use as a moderator variable”, International Journal of Hospitality Management, 37(3), 303-329.
Hellebusch, S. (2000); “Don’t read research by the numbers”, Marketing News, 34(19), 25-38.
Hennink, M.; Hutter, I.; Bailey, A. (2011); Qualitative research methods, Thousand Oaks, Sage Publications.
INCQS – Instituto Nacional de Controle de Qualidade em Saúde. (2013); Ensaios de proficiência, Disponible en: www.incqs.fiocruz.br, Asesado en: 03 set. 2013.
Juran, J. M.; De Feo, J. (2010); Juran’s quality handbook: the complete guide to performance excellence, 6th edition, New York, McGraw-Hill.
Lima-Oliveira, G. S.; Picheth, G.; Sumita, N.M.; Scartezini, M. (2009); “Controle da qualidade na coleta do espécime diagnóstico sanguíneo: iluminando uma fase escura de erros pré-analíticos”, Jornal Brasileiro de Patologia Médica e Laboratorial, 45(6), 441-447.
Malhotra, N. K.; Birks, D.; Wills, P. (2012); Marketing research: applied approach, 4th edition, New York, Pearson.
Mendes, M. E. (1998); Avaliação da implementação de um sistema de qualidade em um laboratório clínico público, Tese de Doutorado, São Paulo, Faculdade de Medicina, Universidade de São Paulo.
Metha, S. (2011); “Service quality as predictor of patient satisfaction: a study of the health care sector”, Journal of Health Management, 13(2), 211-229.
Nehme, N. S. (2008); Implantação de um sistema de gestão da qualidade em um laboratório de pesquisa do Instituto Oswaldo Cruz (IOC): desafios e soluções da realidade do programa PALC da SBPC/ML, Dissertação de Mestrado, São Paulo, Escola Nacional de Saúde Pública Sergio Arouca.
Piva, L. C.; Fumagalli, L. A. W.; Baptista, P. P.; Silva, W. V. (2007); “Relação entre satisfação, retenção e rentabilidade de cliente no setor de planos de saúde”, Revista de Ciências da Administração, 9(19), 54-80.
Plebani, M. (2007); “Errors in laboratory medicine and patient safety: the road ahead”, Clinical Chemistry Laboratory Medical, 45(6), 700-707.
Plebani, M. (2009); “Exploring the iceberg of errors in laboratory medicine”, Clinical Chemistry Acta, 404, 16-23.
PNCQ – Programa Nacional de Controle de Qualidade. (2013a); Histórico, Disponible en: www.pncq.org.br, Asesado en: 01 set. 2013.
PNCQ – Programa Nacional de Controle de Qualidade. (2013b); PNCQ gestor, Disponible en: www.pncq.org.br. Asesado en: 01 set. 2013.
PNCQ – Programa Nacional de Controle de Qualidade. (2013c); Manual do Participante 2011, Disponible en: www.pncq.org.br, Asesado en: 01 set. 2013.
Pope, C.; Mays, N. (1995); “Reaching the parts other methods cannot reach: an introduction to qualitative methods in health and health service research”, BritishMedicalJournal, 311, 560-569.
Ramanujam, P. G. (2011); “Service quality in health care organisations: a study of corporate hospitals in Hyderabad”, Journal of Health Management, 13(2), 177-202.
RDC Nº 302/2005 – Resolução da Diretoria Colegiada, 13 de outubro de 2005. (2005); Dispõe sobre regulamento técnico para funcionamento de laboratórios clínicos, Disponble en: www.anvisa.gov.br, Asesado en: 01 mai 2013.
Remler, D. K.; Van Ryzin, G. G. (2011); Research methods in practice: strategies for description and causation, Thousand Oaks, Sage Publications.
Ricós, C.; Garcia-Victoria, M.; Fuente, B. (2004); “Quality indicators and specifications for the extra-analytical phases in clinical laboratory management”, Clinical Chemistry and Laboratory Medicine, 42(6), 578-582.
SBAC – Sociedade Brasileira de Análises Clínicas. (2013); Histórico, Disponible en: www.sbac.org.br, Asesado en: 15 dec. 2013.
Scott, G.; Garner, R. (2013); Doing qualitative research: designs, methods, and techniques, 1st edition, Upper Saddle River, Pearson.
Vieira, K. F. (2012); Impacto da implantação de um programa de acreditação laboratorial, avaliado por meio de indicadores de processo, num laboratório clínico de médio porte, Dissertação de Mestrado, São Paulo, Faculdade de Medicina, Universidade de São Paulo.
Vieira, K. F.; Shitara, E. S.; Mendes, M. E.; Sumita, N. M. (2011); “A utilidade dos indicadores da qualidade no gerenciamento de laboratórios clínicos”, Jornal Brasileiro de Patologia Médica e Laboratorial, 47(3), 201-210.
Westgard, J. O.; Barry, P. L.; Tomar, R. H. (1991); “Implementing total quality management (TQM) in healthcare laboratories”, Clinical Laboratory Management Review, 5(5), 353-370.
Westgard, J. O.; Darcy T. (2004); “The truth about quality: medical usefulness and analytical reliability of laboratory tests”, Clinical Chemistry Acta,346(1), 3-11.
Yin, R. K. (2005); Estudo de caso: planejamento e métodos, 3. ed., Porto Alegre, Bookman.
1. UCS – Universidade de Caxias do Sul – Brasil. Email: gsmilan@ucs.br
2. UCS – Universidade de Caxias do Sul – Brasil. Email: dani.s.trevisan@gmail.com
3. UCS – Universidade de Caxias do Sul – Brasil. Email: leberle@ucs.br
4. UCS – Universidade de Caxias do Sul – Brasil. Email: fernandalazzari@hotmail.com
5. UCS – Universidade de Caxias do Sul – Brasil. Email: DToni2@ucs.br