

Vol. 38 (Nº 14) Año 2017. Pág. 27
Tomaz LONGHI-SANTOS¹, Jaçanan Eloísa de Freitas MILANI 1; Franklin GALVÃO 1; Christopher Thomas BLUM 1; Carlos Vellozo RODERJAN 1; Bruno Palka MIRANDA 1; Maria Raquel KANIESKI 2
Recibido: 26/09/16 • Aprobado: 25/10/2016
RESUMO: O objetivo deste trabalho foi testar a influência de variáveis ambientais sobre o estabelecimento de plântulas de Hovenia dulcis Thunberg (Rhamnaceae) no interior de um remanescente florestal, pressupondo que ao menos uma das variáveis seja determinante no controle populacional da espécie. Foram selecionados indivíduos adultos de H. dulcis, a partir dos quais foram estabelecidos 72 pontos amostrais de 0,5 m2, monitorados mensalmente. A tentativa de estabelecimento de plântulas ocorreu entre julho/2011 (inverno) e janeiro/2012 (verão), não havendo sobrevivência após este período. Verificou-se que a intensidade luminosa, decorrente das fenofases da espécie, foi a única variável que apresentou correlação significativa. |
ABSTRACT: The objective of this study was to test the influence of the environmental variables on the establishment of Hovenia dulcis Thunberg seedling in a patch of Araucaria Rainforest, assuming that at least one of the considered variables could be crucial on the control of the population of this species. Adult individuals were selected for this research. From these trees there were established 72 samples of 0.5 m². Seedlings density and the environmental variables were monitored monthly. The seedlings establishment attempt occurred only from July/2011 (winter) to January/2012 (summer), without survival after this period. Using the Pearson correlation it was possible to verify that the light intensity, result from the phenology of the species, was the only variable with significant correlation. |
As espécies florestais utilizam estratégias ecológicas distintas para ocupação de áreas após um distúrbio, natural ou antrópico. A partir dos distúrbios, novos recursos são disponibilizados às plantas, a exemplo da intensidade de luz que passa a incidir sobre o solo e dar condições para germinação de um banco de sementes (Martins, 2008).
Não obstante as espécies nativas manterem duradouramente um banco de sementes e de plântulas no interior das florestas, a dispersão de sementes pelo vento, água e animais facultam às espécies exóticas a possibilidade de vir a integrar este banco. Assim, atuam também na ocupação e colonização de áreas, alterando a dinâmica natural de sucessão florestal, uma vez que a disputa por recursos do ambiente pode ser desproporcional.
Espécies exóticas invasoras são organismos que, uma vez introduzidos em um novo ambiente, se estabelecem e passam a desenvolver populações auto-regenerativas, a ponto de ocupar o espaço de espécies nativas e proporcionar alterações nos processos ecológicos naturais, tendendo a se tornar dominantes e podendo causar impactos ambientais e socioeconômicos negativos (Zalba, 2006).
O fato de ser uma espécie exótica não necessariamente a rotula como um potencial invasor biológico. O paradigma central de uma possível invasão biológica aponta que quanto maior for o número de indivíduos de uma espécie exótica ocorrentes numa área, maior é a probabilidade de uma população exótica se estabelecer e por fim se estruturar nesta mesma área (Blackburn et al. 2013).
A dinâmica de recrutamento de indivíduos em uma clareira, nativos ou exóticos, passa por processos diferentes daqueles do interior de uma floresta (Armelin e Mantovani, 2001). Assim, uma espécie que em ambiente aberto é potencialmente invasora, no interior de um fragmento pode não ter esse mesmo sucesso de ocupação.
Hovenia dulcis Thunberg (Rhamnaceae), popularmente conhecida como uva-do-japão, é uma espécie arbórea originária do sudeste asiático,amplamente utilizada em parques e na arborização urbana na América do Sul (Argentina, Paraguai e Brasil) (Carvalho, 1994; Lorenzi e Souza, 2003). Originalmente cresce em solos compactados, rasos e pedregosos, arenosos a argilosos, mostrando restrição apenas a solos de baixa fertilidade química, podendo atingir 25 m de altura e mais de 70 cm de DAP, com fuste reto e cilíndrico (Carvalho, 1994). As sementes são orbiculares, apresentam coloração castanho-claro e germinação epígea fanerocotiledonar (Castro et al., 2005). A espécie tem regeneração intensa por sementes (Carvalho,1994) e por ter um tegumento espesso, possui dormência.
Por apresentar características de espécie pioneira (Carvalho e Nakagawa, 1980), ocorre em áreas abertas, mas também é encontrada com frequência no interior de fragmentos florestais, com distribuição espacial mais esparsa (Barddal, 2004). Sua presença interfere negativamente no crescimento diamétrico das espécies nativas devido à competição pelos recursos disponíveis na área (Kanieski et al., 2012), além de impedir ou dificultar a regeneração das espécies arbóreas autóctones, em decorrência de características alelopáticas (Wandscheer et al., 2011).
A espécie tem grande facilidade de dispersão zoocórica (Ziller, 2001), e no estado do Paraná comumente domina o estrato superior de florestas aluviais, ocupando o espaço de diversas espécies nativas. Este tipo de ambiente específico tem se mostrado favorável ao estabelecimento de espécies exóticas, já que a hidromorfia minimiza as limitações de seca, garantindo o crescimento e condições de reprodução (Lake e Leisham, 2004), assim como o favorecimento da dispersão por meio das florestas aluviais como corredores ecológicos.
Deste modo, o objetivo deste trabalho foi avaliar a influência das variáveis ambientais temperatura, precipitação e intensidade luminosa no estabelecimento espontâneo de plântulas de Hovenia dulcis no interior de um fragmento de Floresta Ombrófila Mista Aluvial paranaense, pressupondo que ao menos uma das variáveis consideradas seja determinante no controle populacional dessa espécie.
A área de estudo está localizada em um fragmento florestal no município de Araucária, PR, na Região Metropolitana de Curitiba (Figura 1). Está cerca de 20 km ao sul da capital paranaense, próxima às coordenadas 25o34’02,5”S; 49o20’53,5”W, a uma altitude média de 880 m s.n.m., na porção centro-sul do primeiro planalto, sobre a formação geológica Guabirotuba.
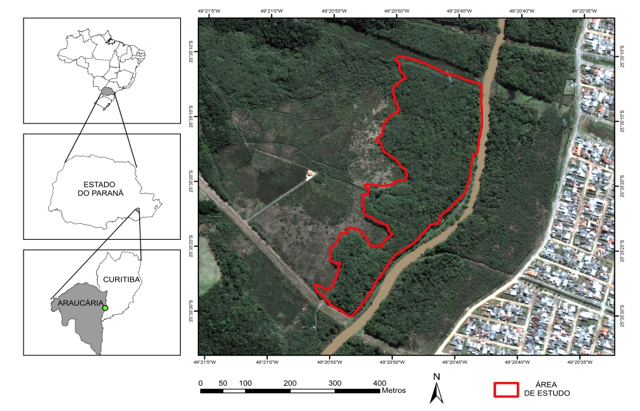
Figura 1. Localização da área de estudo.
O clima regional, segundo a classificação de Koeppen, enquadra-se como Cfb - temperado, com verões frescos, geadas frequentes, sem estação seca definida (Milani, 2013). As médias anuais de temperatura registradas no local foram de 25,4°C no mês mais quente (fevereiro) e de 10,3°C no mês mais frio (julho); a precipitação média anual é de aproximadamente 1460 mm (Longhi-Santos, 2013), sendo o mês mais seco março (35 mm).
O principal coletor da drenagem natural da área de estudo é o rio Barigui, um dos mais relevantes afluentes na margem direita do Alto Rio Iguaçu. No final da década de 1960, este rio passou por um processo de retificação, o que acarretou na perda de suas características meandrantes, deixando no interior do fragmento florestal evidências de seu antigo leito (Barddal et al., 2004).
Predominam os Gleissolos, de origem alúvio-coluvionar, formados por deposição de sedimentos de fina granulometria (Barddal et al., 2004). Estes solos são hidromórficos, mal ou muito mal drenados, submetidos à saturação hídrica permanente ou sazonal por ascensão do lençol freático ou por transbordamento do rio em cheias (Embrapa, 2013).
A vegetação local é enquadrada como Floresta Ombrófila Mista Aluvial (IBGE, 2012) e tem como espécie arbórea que melhor representa esta fitofisionomia o branquilho, Gymnanthes klotzschiana Müll.Arg. (Euphorbiaceae). Dado ao seu caráter de espécie pioneira, possui capacidade e plasticidade para ocupar solos hidromórficos ou recém formados pela deposição de sedimentos dos rios (Barddal et al., 2004).
Apesar de preservar características de um ambiente relativamente conservado, no fragmento em estudo também ocorrem espécies exóticas invasoras, com destaque para Hovenia dulcis e Ligustrum lucidum W.T. Aiton, ambas incluídas na Lista Oficial de Espécies Exóticas Invasoras para o estado do Paraná (Paraná, 2007).
H. dulcis tem seu período de senescência foliar iniciado em meados de março e seu pico de queda foliar em agosto, onde todos os indivíduos encontram-se desprovidos de folhas, permitindo a passagem direta de luz para o sub-bosque, conforme registros feitos por Milani (2013), nesta mesma área de estudo.
No que tange ao seu comportamento reprodutivo, adotou-se o que foi descrito por Milani (2013) para o mesmo fragmento aluvial: H. dulcis apresenta o desenvolvimento de botões florais em agosto, seguido do início da frutificação em novembro. Os frutos maduros foram registrados a partir de março, com o fim do período reprodutivo em agosto.
Para a consecução do presente estudo foram selecionados como pontos amostrais seis indivíduos adultos de H. dulcis (Tabela 1), todos de dossel, distribuídos no remanescente de floresta aluvial. Estes indivíduos fazem parte de um conjunto de árvores da comunidade florestal que vem tendo seu incremento diamétrico e comportamento fenológico monitorados mensalmente desde julho de 2009, com previsão de término em 2019 (Milani, 2013). As idades de cada indivíduo selecionado foram estimadas a partir da contagem de anéis de crescimento em amostras extraídas com um trado de Pressler. Seu diâmetro de copa foi obtido através da média de quatro raios de projeção da copa medidos nos sentidos norte, sul, leste e oeste.
Em cada ponto amostral, tomando como referência a base da árvore selecionada, foram estabelecidas linhas amostrais nos sentidos norte, sul, leste e oeste. Ao longo de cada linha foram instaladas três parcelas circulares de 50 cm de diâmetro, sendo uma a 10 cm da base da árvore, a segunda no ponto médio entre a base e o limite de projeção de copa e a terceira no limite de projeção da copa. Assim, cada ponto amostral foi composto por quatro quadrantes e cada quadrante por três parcelas, totalizando 12 parcelas e uma área amostral de 6 m² (Figura 2).
Tabela 1. Características dendrométricas de cada matriz árvore-amostra de Hovenia dulcis. DAP é o diâmetro à altura do peito; DC é o diâmetro de copa; ID é a idade; e os incrementos em diâmetro, mínimo (Mín.), médio (Méd.) e máximo (Máx.).
Árvore |
DAP (m) |
DC (m) |
ID (anos) |
Incremento (mm/ano) |
||
Mín. |
Méd. |
Máx. |
||||
Arv. 1 |
0,31 |
8,9 |
23 |
0,19 |
0,98 |
1,97 |
Arv. 2 |
0,24 |
6,3 |
26 |
0,06 |
1,33 |
2,55 |
Arv. 3 |
0,57 |
12,4 |
26 |
0,00 |
0,54 |
0,95 |
Arv. 4 |
0,24 |
6,5 |
23 |
0,45 |
1,47 |
2,48 |
Arv. 5 |
0,16 |
4,4 |
23 |
0,19 |
0,96 |
1,85 |
Arv. 6 |
0,31 |
6,9 |
26 |
0,45 |
1,91 |
3,76 |
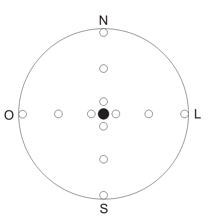
Figura 2. Esquema gráfico do delineamento de instalação das parcelas.
Base do fuste do indivíduo, ao centro, em preto; projeção da copa, representada0
pelo círculo maior e as parcelas alocadas em cada quadrante.
Dentro de cada parcela foi realizada a contagem do número de plântulas de H. dulcis. Para tal foram consideradas plântulas aqueles indivíduos com estruturas características e essenciais da espécie: raiz, hipocótilo, cotilédones e gema apical, conforme Aguiar et al. (1993) (Figura 3).
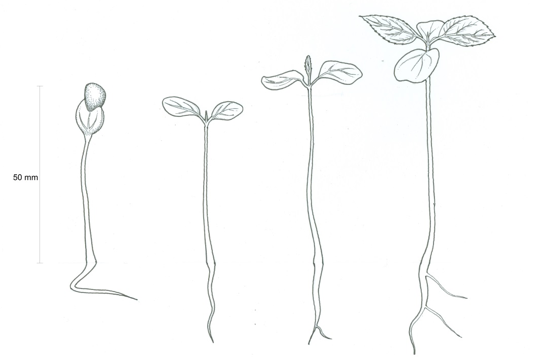
Figura 3. Plântulas de H. dulcis em diferentes fases de desenvolvimento consideradas no levantamento.
No centro de cada parcela, mensalmente, foi também registrada a intensidade luminosa incidente, com auxílio de um luxímetro digital, sempre em dias sem nebulosidade e no período entre 10 horas e 12 horas da manhã. As referidas informações foram coletadas mensalmente ao longo de um ciclo de estabelecimento, de julho/2011 e junho/2012. As variáveis temperatura e precipitação foram obtidas de uma estação meteorológica instalada na área de estudo. As possíveis relações entre a densidade de plântulas, as variáveis ambientais e o comportamento fenológico das matrizes, essas obtidas concomitante de Milani (2013), foram analisadas por meio de correlação de Pearson, utilizando esta função no aplicativo Microsoft Excel.
O início da germinação de sementes e do estabelecimento de H. dulcis no remanescente de floresta aluvial se dá em julho, atingindo seu pico máximo em setembro, a partir do qual há um declínio acentuado, tendo janeiro como limite de sobrevivência das plântulas (Figura 4 - A). O ciclo que se inicia na germinação das sementes e termina com a morte de todas as plântulas, portanto, tem uma duração de apenas de sete meses. Entre o oitavo (fevereiro/2012) e o décimo segundo mês (junho/2012) não houve plântulas sobreviventes.
Segundo Carvalho e Nakagawa (1980), a germinação de sementes está ligada à temperatura do ambiente e a absorção de água, que, por sua vez, está relacionada à precipitação. Estes mesmos autores verificaram que a temperatura ideal para germinação das sementes de H. dulcis deve estar entre 20 e 30ºC. Entretanto, o que se percebe neste estudo é que provavelmente esses fatores estejam atuando de maneira secundária na regeneração de H. dulcis.
Durante este período, acompanhando o conjunto de dados, verifica-se que a temperatura média do ar esteve sempre abaixo dos 20ºC, com valores gradativamente maiores com a aproximação do verão. Com o aumento da temperatura, não houve um acréscimo no estabelecimento de plântulas. A precipitação também não interferiu na densidade de plântulas, uma vez que no mês de setembro se observa o maior número de plântulas e um dos menores valores de precipitação (Figura 4 - B). Quando correlacionados os parâmetros de precipitação (r= 0,2320 p<0,05) e de temperatura média (r= 0,0859 p<0,05) com o total de plântulas ao longo do período de observação, verificou-se que não há correlação significativa.
Diferente do que foi constatado em relação à precipitação e a temperatura, a intensidade luminosa mostrou ser significativamente correlacionada (r= 0,7341 p<0,05). Segundo Whitmore (1996), dentre os parâmetros microclimáticos, a radiação solar é provavelmente o mais importante na germinação de sementes e na sobrevivência de plântulas, considerando que a radiação fotossinteticamente ativa e outros fatores microclimáticos são dependentes dela.
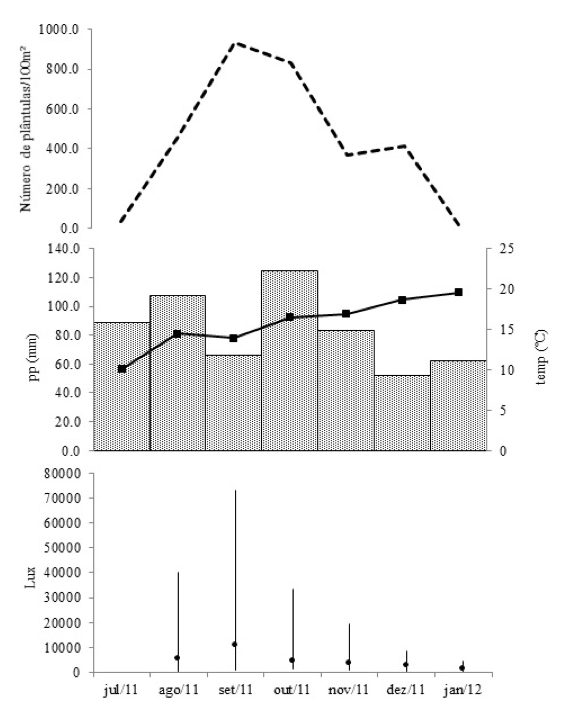
Figura 4. Densidade de plântulas (A), precipitação mensal (barras) e temperatura
média mensal (linhas) (B) e intensidade luminosa (amplitude e média) (C).
A luz é de fundamental importância para o desenvolvimento das plantas (dentro de uma determinada faixa do espectro), uma vez que variações na qualidade e quantidade, presença ou ausência de luz, influenciam no tipo de desenvolvimento que a planta irá apresentar (Poggiani et al., 1992).
Tendo em vista que H. dulcis apresenta comportamento de espécie pioneira, a luz passa a ser o fator preponderante no desenvolvimento e estabelecimento de suas plântulas, pois a sobrevivência está relacionada a um valor mínimo de radiação para que cada indivíduo tenha uma taxa de fotossíntese líquida positiva, ou seja, acima do ponto de compensação. O valor mínimo de radiação que cada indivíduo necessita para ultrapassar o ponto de compensação varia de acordo com a espécie, grupo ecológico, genótipo, tipo de folha, idade da folha (folhas jovens têm um ponto de compensação mais alto que as maduras), concentração de CO2, temperatura etc. (Larcher, 2004; Galvão, 1986; Kozlowski, 1971).
Em espécies pioneiras, o ponto de compensação luminoso é maior que o de espécies não-pioneiras, ou seja, quanto maior a tolerância à sombra, menor será o ponto de compensação (Whitmore, 1996). O ponto de compensação para uma espécie pioneira é em torno de 2.000 lux (Larcher, 2004) e, como pode ser visto na Figura 4 - C, a média de intensidade luminosa no interior da floresta começa a decrescer a partir de outubro, concomitante ao decréscimo de plântulas, indicando que níveis críticos de luz influenciam de maneira significativa a estabilidade da regeneração. Em janeiro, os níveis médios de luminosidade foram menores que 1.400 lux.
A redução da radiação no interior da floresta decorre do ciclo fenológico de produção de folhas. Como observado por Milani (2013), na mesma comunidade florestal, o amadurecimento dos frutos de H. dulcis se dá a partir de março e vai até meados de agosto, justamente no período em que sua deciduidade atinge o auge, deixando as árvores totalmente sem folhas.
Segundo Reid et al. (1991), as espécies evoluíram ajustando seus mecanismos para identificar informações do ambiente luminoso, que alteram o crescimento e desenvolvimento vegetal ou atuam como um sinal que leva à expressão da plasticidade fenotípica presente em todas as plantas, otimizando a aquisição de recursos.
H. dulcis sincroniza a queda de suas folhas com a maturação dos frutos, favorecendo a germinação daquelas sementes que atingem o solo, mostrando correlação significativa entre as variáveis densidade de plântulas versus porcentagem de folhas nas copas das árvores (r=0,4732; p<0,05) (Figura 5).
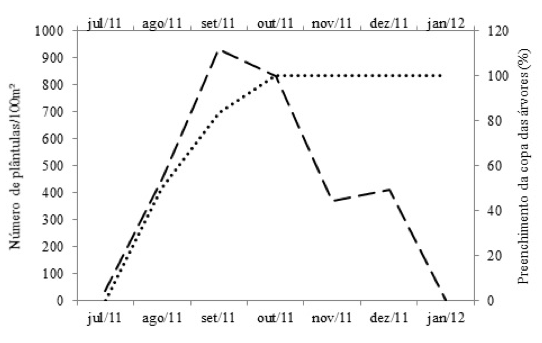
Figura 5. Porcentagem de folhas nas copas das árvores amostradas (pontilhado)
(Adaptado de Milani, 2013) e a densidade de plântulas (tracejado).
Apesar desta sincronia, o período entre a germinação do banco de sementes e a reposição foliar das matrizes de H. dulcis que compõem o dossel não é suficientemente longo para permitir o recrutamento definitivo dos indivíduos novos (Figura 5). A redução de radiação solar no interior da floresta, em consequência da reposição de folhas de H. dulcis, remete a questão do ponto de compensação luminoso. A radiação que atinge o solo da floresta é dependente das aberturas do dossel, assim, preenchimento de copa e intensidade luminosa são inversamente proporcionais, aspecto já ressaltado por Larcher (2004).
É importante ressaltar a influência da espécie nativa dominante deste ambiente aluvial, Gymnanthes klotzschiana, que representa mais de 60% do estrato arbóreo (Barddal et al., 2004), e que, devido a sua característica fenológica de reposição de folhas ocorrendo nos meses de setembro e outubro (Milani, 2013), também regula a luminosidade disponível para o estabelecimento de plântulas da espécie exótica. Desta forma, a conservação da comunidade arbórea nativa de Floresta Ombrófila Mista Aluvial garante o controle de estabelecimento da invasora H. dulcis.
Ressalva-se que durante o período do monitoramento deste estudo não foram registrados pulsos de inundação, eventos comuns em rios com características meandrantes, que pudessem também ser relacionados como indutores dos resultados obtidos.
Dentre os parâmetros analisados, temperatura e precipitação não se correlacionam significativamente à quantidade da regeneração (número de plântulas) de H. dulcis na área em questão. Apesar de serem fatores microclimáticos fundamentais à germinação de sementes e limitantes à sobrevivência das mesmas, neste caso dão indicativos de que atuam de maneira secundária para o desenvolvimento das plântulas nas condições do presente estudo.
A intensidade luminosa se apresenta como fator determinante para o sucesso da regeneração de H. dulcis no interior do fragmento. As próprias matrizes acabam por limitar o crescimento das plântulas devido ao sombreamento provocado pela copa.
A afirmativa de que H. dulcis é uma espécie invasora em qualquer circunstância parece não se aplicar na área de estudo (Floresta Ombrófila Mista Aluvial), uma vez que os indivíduos amostrados não obtiveram sucesso na regeneração, mesmo com frutificação e germinação abundantes.
Como todos os indivíduos amostrados possuem mais de 20 anos, adultos, portanto, é possível afirmar que o sucesso dessa espécie como invasora depende de distúrbios naturais ou antrópicos de certa magnitude, o suficiente para garantir uma intensidade de radiação que permita a germinação e a sobrevivência das plântulas. Por outro lado, a presença de indivíduos adultos de H. dulcis na área representa, com base nas informações obtidas, uma ameaça à integridade das florestas aluviais, tendo em vista que o banco de sementes tem possibilidade se renovar anualmente.
Aguiar, I. B., & Piña-Rodrigues, F. C. M., Figliolia, M. B.(1993). Sementes florestais tropicais. Brasília: Associação Brasileira de Tecnologia de Sementes.
Armelin, R. S., & Mantovani, W. (2001). Definições de clareira natural e suas implicações no estudo da dinâmica sucessional em florestas. Rodriguésia, 52(1), 5-15.
Barddal, M. L., Roderjan, C. V., Galvão, F., & Curcio, G. R. (2005). Caracterização florística e fitossociológica de um trecho sazonalmente inundável de floresta aluvial, em Araucária, PR. Ciência Florestal, 14(2), 37-50.
Blackburn, T. M., Prowse, T. A., Lockwood, J. L., & Cassey, P. (2013). Propagule pressure as a driver of establishment success in deliberately introduced exotic species: fact or artefact? Biological Invasions, 15(7), 1459-1469.
Carvalho, N. M., & Nakagawa, J. (1980). Sementes: Ciência, tecnologia e produção (3.ed). Campinas: Fundação Cargil.
Carvalho, P. E. R. (1994). Ecologia, silvicultura e usos da Uva-do-japão (Hovenia dulcis Thunberg). Colombo: EMBRAPA-CNPF.
Castro, T. C., Barbosa, K. C., Albarello, N., Figueiredo, S. F. L. (2005). Caracterização de pseudofrutos, frutos, sementes e plântulas obtidas a partir de germinação in vivo e in vitro da espécie medicinal Hovenia dulcis (Rhamnaceae). Revista Cubana de Plantas Medicinais, 10(1). Recuperado em 18 de setembro de 2016, de http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S102847962005000100012&lng=es&tlng=es
Solos, E. (2013). Sistema brasileiro de classificação de solos. Rio de Janeiro: Centro Nacional de Pesquisa de Solos.
Galvão, F. (1986). Variação sazonal de fotossíntese líquida e respiração de Cabralea canjerana (Vell.) Mart., Ilex paraguariensis S.t. Hil e Podocarpus lambertii, Kl. em função da intensidade luminosa e temperatura. (Tese de doutoramento). Universidade Federal do Paraná. Curitiba.
IBGE. (2012) Manual Técnico da Vegetação Brasileira (2ª ed.). Rio de Janeiro: Instituto Brasileiro de Geografia e Estatística.
Kanieski, M.R., Longhi-Santos, T., Graf-Neto, J., Souza, T., Galvão, F., & Roderjan, C.V. (2012) - Influência da precipitação e da temperatura no incremento diamétrico de espécies florestais aluviais em Araucária-PR. Floram, Seropédica, 19(1), 17-25.
Koller, G. L., & Alexander, J. H. (1979). The raisin tree-its use, hardiness and size. Arnoldia, 39(1), 7-15.
Kozlowski, T. T. (1971). Growth and development of trees. Volume II. Cambial growth, root growth, and reproduction growth. Londres: Academic Press.
Larcher, W. (2004). Ecofisiologia vegetal. São Carlos: Rima.
Lake, J.C., & Leishman, M.R. (2004). Invasion success of exotics in natural ecosystems: the role of disturbance, plant attributes and freedom from herbivores. Biological Conservation, 117(2), 215-226.
Lorenzi, H. (2003). Árvores exóticas do Brasil: madeireiras, ornamentais e aromáticas. Nova Odessa. Instituto Plantarum de Estudos da Flora.
Longhi-Santos, T. (2013). Dendroecologia de Sebastiania commersoniana (Baill.) L.B.Sm. & Downs em um fragmento de Floresta Ombrófila Mista Aluvial, Paraná, Brasil. (Dissertação). Universidade Federal do Paraná. Curitiba.
Martins, S. V., Almeira, D.P., Fernandes, L.V., & Ribeiro, T.M. (2008). Banco de sementes como indicador de restauração de uma área degradada por mineração de caulim em Brás Pires, MG. Revista Árvore, 32(6), 1081-1088.
Milani, J.E.F. (2013). Comportamento fenológico de espécies arbóreas em um fragmento de Floresta Ombrófila Mista Aluvial – Araucária, PR. (Dissertação). Universidade Federal do Paraná. Curitiba.
Paraná. (2007). Portaria IAP n° 074, de 22 de maio de 2007. Reconhece a Lista Oficial de Espécies Exóticas Invasoras para o estado do Paraná, estabelece normas de controle e dá outras providências. Curitiba: Instituto Ambiental do Paraná.
Poggiani, F; Bruni, S; & Barbosa, E.S.Q. (1992). Efeito do sombreamento sobre o crescimento das mudas de três espécies florestais. Revista do Instituto Florestal de São Paulo. 4 (2), 564-569.
Reid, D.M., Beall, E.D., & Pharis, R.P. (1991). Environmental cues in plant growth and development. In: Steward. F. C. (Org.). Plant Physiology. San Diego: Academic Press.
Wandscheer, A.C.D.; Borella. J.; Bonatti, L.C.; & Pastorini, L.H. (2011). Atividade alelopática de folhas e pseudofrutos de Hovenia dulcis Thunb. (Rhamnaceae) sobre a germinação de Lactuca sativa L. (Asteraceae). Acta Botonica Brasilica. 25(1), 25-30.
Whitmore, T.C. (1996). A review of some aspects of tropical rain forest seedling ecology with suggestions for further enquiry. In: Swaine, M.D., Alexander, I. (Orgs.). Ecology of tropical tree seedlings. Man and Biosphere Series. Paris: UNESCO.
Zalba, S. M. (2006). Introdução às Invasões Biológicas – Conceitos e Definições. In: Brand, K. (Org.). América do Sul invadida: A crescente ameaça das espécies exóticas invasoras. Cape Town: Programa Global de Espécies Invasoras – GISP.
Ziller, S.R. (2001). Plantas exóticas invasoras: a ameaça da contaminação biológica. Ciência Hoje, 1(178), 77-79.
1. Departamento de Ciências Florestais, Universidade Federal do Paraná. Jardim Botânico, Curitiba - PR. Brasil. E-mail: tomazlonghi@gmail.com
2. Departamento de Engenharia Florestal, Universidade do Estado de Santa Catarina. Lages – SC, Brasil.