

Vol. 38 (Nº 03) Año 2017. Pág. 25
Camila Thomaz DOS SANTOS 1; Fernanda Couto MILÉO 2; Eduardo Bauml CAMPAGNOLI 3; Shelon Cristina SOUZA PINTO 4; Luís Antônio ESMERINO 5; Evelyn Lopez LEITE 6
Recibido: 07/08/16 • Aprobado: 03/09/2016
RESUMO: A microbiota bucal da pessoa idosa é mais suscetível ao desequilíbrio, principalmente pelas alterações fisiológicas do envelhecimento e por doenças bucais e sistêmicas que possam ocorrer. No internamento, a microbiota bucal é composta por microrganismos incomuns em cavidade bucal, mas que desencadeiam a Pneumonia Associada à Ventilação Mecânica (PAV). Objetivo: Verificar o crescimento de microrganismos (Enterococcus spp., Pseudomonas spp., Klebsiella spp. e Staphylococcus spp.) relacionados à PAV, na cavidade bucal de idosos internados, em Unidade de Terapia Intensiva (UTI) e Clínica Médica Hospitalar, em três diferentes tempos de internamento (0h, 48h e 96h). Métodos: A amostra foi de 30 pacientes (15 em cada setor), onde realizaram-se coletas de material biológico em dorso de língua de cada paciente nos três tempos. Resultados: Obteve-se crescimento de microrganismos em todos os meios de cultura utilizados. Identificaram-se todos os microrganismos elencados na pesquisa, estando presentes também o Staphylococcus spp. e a Klebsiella spp. com padrões de multirresistência. Conclusão: A presença de microrganismos resistentes na cavidade bucal de pacientes internados, principalmente em UTI, demonstrou a importância da higiene bucal durante o internamento hospitalar, para controle da microbiota bucal e prevenção de pneumonias. |
ABSTRACT: The oral microbiota of elderly person is more susceptible to imbalance, especially the physiological changes of aging and oral/systemic diseases that may occur. In the hospital, the oral microbiota is composed of unusual microorganisms in the oral cavity, but that trigger the Ventilator Associated Pneumonia (VAP). Objective: To assess the growth of microorganisms (Enterococcus spp., Pseudomonas spp., Klebsiella spp. and Staphylococcus spp.). Related to the VAP in the oral cavity of elderly patients in the Intensive Care Unit (ICU) and Clinical Hospital, at three different times hospitalization (0h, 48h and 96h). Methods: The sample consisted of 30 patients (15 in each sector), which took place biological material collected in tongue dorsum of each patient in three stages. Results: Obtained microbial growth in all the culture media used. We identified all the microorganisms listed in the survey, are also present Staphylococcus spp. and Klebsiella spp. with multidrug resistance patterns. Conclusion: The presence of resistant microorganisms in the oral cavity of hospitalized patients, especially in ICU, showed the importance of oral hygiene in the hospital for control of oral microbiota and prevention of pneumonia. |
A microbiota bucal residente é essencial para saúde em um indivíduo, pois participa no desenvolvimento do sistema imune e serve de barreira contra microrganismos patogênicos. Na cavidade bucal existem mais de 700 espécies de microrganismos, que promovem a homeostase bucal (Zarco et al, 2012; Glurich et al, 2014). Estudos demonstram que na cavidade bucal de indivíduos saudáveis, os microrganismos mais comuns encontrados correspondem ao Streptococcus, Veillonella, Neisseira, Prevotella e Fusobacterium (Hasan et al, 2014; Washio et al, 2014).
No entanto, quando há um desequilíbrio da microbiota bucal, as bactérias residentes associam-se com a etiologia de alterações bucais como a doença cárie e a doença periodontal, e de alterações sistêmicas, principalmente infecções do trato respiratório (Glurich et al, 2014; Aguiar e Oliveira, 2008).
Em pessoas com 60 anos ou mais de idade, o desequilíbrio da microbiota bucal é mais intenso. Em função das alterações fisiológicas do envelhecimento (principalmente a desidratação de pele e mucosa) e de doenças bucais e sistêmicas que possam ocorrer, a mucosa bucal é menos resistente, favorecendo a proliferação de microrganismos patogênicos. A alteração da microbiota bucal, assim como a maior idade e o internamento em uma unidade Hospitalar expõe o organismo à condição de vulnerabilidade às Infecções Relacionadas à Assistência à Saúde (IRAS) (Oliveira et al, 2007; Fidel et al, 2013).
As IRAS são consideradas as principais causas de morbidade e de mortalidade no âmbito hospitalar, além de aumentarem o tempo de internamento do paciente, elevando o custo do tratamento (ANVISA, 2004). Dentre as IRAS mais comuns e que apresentam maior relação com a área odontológica podem-se citar as infecções do trato respiratório como a Pneumonia Associada à Ventilação Mecânica – PAV (Aguiar e Oliveira, 2008). Esta infecção é responsável por cerca de 25% de todas as infecções adquiridas durante o internamento em Unidade de Terapia Intensiva (UTI), e se desenvolve após 48 horas de intubação, sendo os cinco primeiros dias o período de maior ocorrência (Diaz e Silveira, 2011; ANVISA, 2013). As taxas de mortalidade em relação à PAV podem variar de 20 a 60%, porém esta infecção aumenta em média 12 dias o tempo de internamento hospitalar, aumentando riscos de morbimortalidade ao paciente (ANVISA, 2013).
A PAV e as outras infecções do trato respiratório podem ter origem por diversos microrganismos hospitalares como Klebsiella spp., Pseudomonas spp. e Staphyloccocus aureus (Diaz e Silveira, 2011; Guimarães e Rocco, 2006). Estes patógenos, que não são geralmente encontrados na cavidade bucal, podem estar presentes na microbiota bucal do paciente internado, principalmente em idosos, disseminando-se pelo organismo (Fidel et al, 2013). Também podem haver infecções de origem odontológica que ocasionarão ou potencializarão doenças sistêmicas, comprometendo a saúde geral do paciente (Amaral et al, 2009). Um indivíduo que apresenta um quadro de periodontite crônica, por exemplo, possui maior risco de desenvolver, descompensar ou intensificar doenças sistêmicas como hipertensão (Glurich et al, 2014; Desvarieux et al, 2010), diabetes (Galhardo et al, 2015), doença renal (Glurich et al, 2014; Kshirsagaret al, 2005), doença arterial coronariana (Glurich et al, 2014), acidente vascular cerebral (Glurich et al, 2014; Fidel et al, 2013), além da pneumonia aspirativa (Aguiar e Oliveira, 2008; Fidel et al, 2013).
Por existirem poucos estudos que relacionam a presença destes microrganismos na microbiota bucal e à PAV, optou-se pela realização do presente estudo. Assim, o objetivo desta pesquisa foi verificar a presença de microrganismos (Staphylococcus spp., Pseudomonas spp., Klebsiella spp., e Enterococcus spp.) relacionados à PAV na microbiota bucal em três momentos diferentes (inicial – 0 hora, 48 horas e 96 horas do internamento), nos pacientes idosos internados na Unidade de Terapia Intensiva e Clínica Médica Hospitalar.
Esta pesquisa é de natureza observacional, prospectiva e experimental, a qual foi realizada entre maio a novembro de 2015, no Hospital Universitário Regional dos Campos Gerais (HURCG) e no Laboratório de Microbiologia associado ao Curso de Odontologia da Universidade Estadual de Ponta Grossa (UEPG). Este estudo foi aprovado pelo Comitê de Ética em Pesquisa Humana da UEPG (protocolo nº 1.055.799).
No estudo foram incluídos pacientes idosos (com idade igual ou superior a 60 anos), independente do gênero, cor da pele, município de origem e idade; internados na Unidade de Terapia Intensiva Adulto (UTI) ou Clínica Médica do HURCG; sem comprometimento da abertura bucal; e que utilizavam ou não Ventilação Mecânica por intubação orotraqueal. Todos os pacientes inclusos na pesquisa aceitaram participar do estudo, assinando o Termo de Consentimento Livre e Esclarecido - TCLE (o próprio paciente ou seu responsável).
Quanto aos critérios de exclusão, não participaram do estudo os pacientes idosos internados em isolamento, com presença de infecção por bactérias multirresistentes; pacientes idosos internados nas Clínicas de Neurologia e de Infectologia; e aqueles que não tiveram o TCLE assinado por ele ou responsável.
A pesquisa incluiu 15 pacientes internados na UTI e 15 pacientes internados na Clínica Médica, totalizando uma amostra de 30 pacientes. De todos eles, foi feita coleta microbiológica antes da higiene bucal (realizada duas vezes ao dia pelas equipes de Enfermagem das unidades hospitalares com colutório Digluconato de Clorexidina 0,12%). A coleta do material biológico ocorria no primeiro dia do internamento do paciente e a cada 48 horas, sendo feita nos cinco primeiros dias (totalizando no máximo três coletas), independentemente do paciente estar na UTI ou na Clínica Médica. As coletas microbiológicas foram realizadas no período de junho a setembro de 2015, por um dos pesquisadores.
Cada coleta foi feita com uma escova citológica estéril, friccionando-a sob o dorso de língua. Após a coleta, a escova era introduzida em um tubo de ensaio (16x160 mm) com 3mL de solução salina tamponada (PBS), conforme orientação da ANVISA (2013) e armazenada em bolsa térmica. Os tubos de ensaio contendo o PBS foram esterilizados em autoclave apropriada, previamente ao uso. Na sequência, o material coletado era encaminhado para o Laboratório de Microbiologia da UEPG.
De acordo com o Núcleo de Controle de Infecção Hospitalar (NUCIH) do HURCG, os microganismos mais comuns relacionados à PAV na Instituição são: Staphylococcus aureus Resistente à Meticilina (também conhecido como MRSA), a Pseudomonas aerugionosas, a Klebsiella spp. (principalmente a Klebsiella pneumoniae produtora de Carbapenemase – KPC) e o Enterococcus spp. Desta forma, a partir das amostras coletadas, no Laboratório de Microbiologia foi investigado a presença destes microrganismos.
Para cultivo dos microrganismos, a solução contendo escova citológica era inicialmente homogeneizada por um agitador (Vórtex) durante 60 segundos. Em seguida, 100ml desta solução era dispensada no centro das placas de Petri (20x100mm) e com auxílio de um swab estéril realizava-se a semeadura pela técnica da placa cheia (quatro lados), em duplicata. As placas foram armazenadas em estufa a 37°C por 48hs.
Para cada microrganismo a ser analisado foram utilizados meios de cultura específicos, como: Ágar Manitol Sal para Staphylococcus spp.; Ágar Cetrimide para Pseudomonas spp. (principalmente Pseudomonas aeruginosas); Ágar MacConkey para Klebsiella spp.; e Ágar Bile Esculina com Azida para Enterococcus spp. Os meios de cultura foram realizados de acordo com as recomendações do fabricante.
Decorrido o tempo de incubação, os diferentes morfotipos coloniais que cresceram nos meios seletivos foram observados de acordo com suas características macroscópicas e passaram pelo processo da Coloração de Gram.
Para verificar a resistência do Staphyloccocus aureus e da Klebsiella spp., realizou-se o teste de sensibilidade aos antimicrobianos (antibiograma), detectando a resistência ou sensibilidade in vitro aos antimicrobianos de bactérias isoladas de amostras clínicas. Para tanto foi utilizado o método de difusão do disco, que consiste na utilização de discos especiais de papel, impregnados com uma concentração padronizada do antimicrobiano, que são colocados sobre uma placa com o meio de cultura Agar Mueller Hinton, previamente semeado com uma suspensão bacteriana também padronizada do microrganismo. Após o período de incubação de 24 horas, o halo de inibição é medido em milímetros e interpretado como sensível, intermediário ou resistente, de acordo com as normas estabelecidas pelo European Committee on Antimicrobial Susceptibility Testing – Versão 4.0 (EUCAST, 2014).
Em relação aos parâmetros clínicos, verificou-se também junto ao NUCIH da Instituição a listagem dos pacientes participantes da pesquisa que apresentaram, durante o tempo de internamento, Pneumonia Associada à Ventilação Mecânica. Também buscaram-se os microrganismos desencadeadores de tal infecção.
Os resultados da pesquisa foram analisados por meio de estatística descritiva e dos testes estatísticos: Teste Exato de Fisher (para comparar a UTI com a Clínica Médica pelas porcentagens de crescimento de microrganismos nos diferentes tempos) e Teste G de Independência (para analisar o crescimento dos microrganismos nos diferentes tempos de internamento em cada setor hospitalar separadamente). Considerou-se o nível de significância de 5%. Todos os cálculos foram realizados com o programa BioEstat 5.3.
A amostra inicial da pesquisa (primeiro dia de coleta) foram de 15 pacientes internados na UTI e 15 pacientes da Clínica Médica, totalizando 30 idosos. Na segunda coleta (48h), se mantiveram internados 13 pacientes de cada grupo, sendo que no quinto dia de internamento (terceira coleta) permaneceram oito idosos em cada grupo (Tabela 1).
Tabela 1 – Perfil dos pacientes internados na UTI e na Clínica Médica, participantes da pesquisa.
TEMPO DE INTERNAMENTO (h) |
MÉDIA DE IDADE |
GÊNERO %(n) |
TESTE EXATO DE FISHER |
||||
UTI |
CLÍNICA MÉDICA |
UTI |
CLÍNICA MÉDICA |
||||
M |
F |
M |
F |
||||
0 (n=15) |
73,3 |
70,7 |
40 (6) |
60 (9) |
40 (9) |
60 (6) |
p = 0,4661 |
48 (n=13) |
73,5 |
72,1 |
38,5 (5) |
61,5 (8) |
38,5 (5) |
61,5 (8) |
p = 1,0000 |
96 (n=8) |
73,4 |
73,6 |
37,5 (3) |
62,5 (5) |
62,5 (5) |
37,5 (3) |
p = 0,6193 |
Gênero: M – Masculino; F – Feminino.
Fonte: o autor.
Sobre a média de idade dos participantes da pesquisa, obteve-se 73,3 anos dos 15 pacientes da UTI e 70,7 dos 15 idosos da Clínica Médica. Com os outros tempos de coleta, a média de idade variou de acordo com a Tabela 1, na qual observa-se também a distribuição dos idosos por gênero, em relação aos tempos das coletas, não havendo diferença estatística significante entre os grupos (UTI e Clínica Médica).
A presença de microrganismos nos meios de cultura seletivos Ágar Cetrimide, Ágar Mannitol Salt, Ágar Bile Esculina com Azida e Ágar MacConkey foram distribuídos em porcentagem, de acordo com os tempos das coletas.
A porcentagem de crescimento de microrganismos no Ágar Bile Esculina com Azida variou entre os setores hospitalares e os diferentes tempos de internamento (Figura 1). No tempo 0h, houve crescimento de 100% nas amostras da UTI e de 66,6% na Clínica Médica, demonstrando diferença significativa entre os setores no primeiro dia de internamento (Teste Exato de Fisher, p = 0,0421). Em relação aos setores de internamento, não houve diferença significativa nos tempos de 48h (Teste Exato de Fisher, p = 0,6609) e 96h (Teste Exato de Fisher, p = 0,5692). Além disso, houve redução no número de pacientes internados na UTI que apresentaram crescimento microbiano no Ágar Bile Esculina com Azida em relação ao tempo de internamento (Teste G tabelas de contingência L x C, p = 0,0422), conforme visualizado na Figura 1.
Figura 1 - Crescimento de colônias de microrganismos no Ágar Bile Esculina com Azida.

1A – Presença de crescimento de colônias microbianas no meio de cultura Ágar Bile Esculina com Azida, em amostras obtidas de mucosa do dorso de língua de pacientes internados na UTI e na Clínica Médica, nos diferentes tempos de internamento (0h-48h-96h).
* p = 0,0421 ° p = 0,0422
1B – Placa de Petri com crescimento de colônias de Enterococcus spp.
1C – Representação microbiológica das colônias de Enterococcus spp. (cocos Gram positivos).
Fonte: o autor.
Verificou-se, pelas amostras microbianas identificadas do Ágar Bile Esculina com Azida, que realmente eram Enterococcus spp. em 11 pacientes (36,7%), sendo sete idosos da Clínica Médica (46,67%) e quatro pacientes da UTI (26,67%).
O meio de cultura que houve a menor porcentagem de crescimento de microrganismos, quando comparado aos outros meios utilizados na pesquisa, foi o Ágar Cetrimide. Não se verificou diferença estatisticamente significante entre os pacientes que tiveram crescimento de microrganismo no referido meio cultura em relação ao local de internamento (Teste Exato de Fisher, p=1,000) e o tempo de internamento (Teste G tabelas de contingência L x C, p = 0,4192 - UTI e p = 4835 – Clínica Médica), conforme se observa na Figura 2.
Figura 2 - Crescimento de colônias de microrganismos no Ágar Cetrimide.
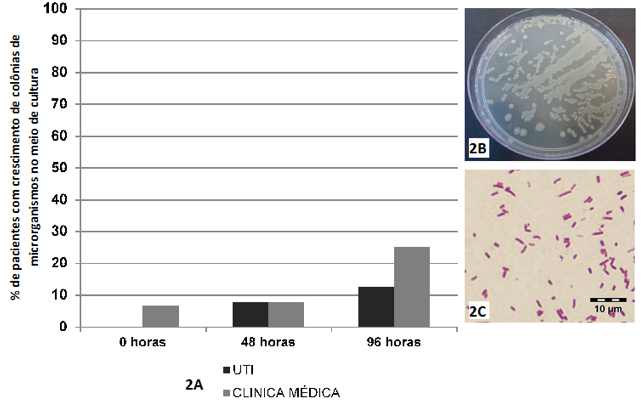
2A – Presença de crescimento de colônias microbianas no meio de cultura Ágar Cetrimide, em amostras obtidas de mucosa do dorso de língua de pacientes internados na UTI e na Clínica Médica, nos diferentes tempos de internamento (0h-48h-96h).
2B – Placa de Petri com crescimento de colônias de Pseudomonas aeruginosas.
2C – Representação microbiológica das colônias de Pseudomonas aeruginosas (bacilos Gram negativos).
Fonte: o autor.
No Ágar Cetrimide, dos microrganismos que cresceram, identificou-se apenas a Pseudomonas aeruginosas, que esteve presente em três indivíduos participantes do estudo (10%), sendo estes internados na UTI. Na Clínica Médica não houve pacientes com crescimento de Pseudomonas aeruginosas no Ágar Cetrimide entre as amostras coletadas.
Em relação ao Ágar MacConkey, verificaram-se mudanças não significativas no crescimento dos microrganismos, tanto entre os setores hospitalares (Teste Exato de Fisher, p = 1,000) quanto entre os diferentes tempos de internamento (Teste G tabelas de contingência L x C, p = 0,4362 - UTI e p = 0,1416 – Clínica Médica) (Figura 3).
Figura 3 - Crescimento de colônias de microrganismos no Ágar MacConkey. 
3A – Presença de crescimento de colônias microbianas no meio de cultura Ágar MacConkey, em amostras obtidas de mucosa do dorso de língua de pacientes internados na UTI e na Clínica Médica, nos diferentes tempos de internamento (0h-48h-96h).
2B – Placa de Petri com crescimento de colônias de Klebsiella pneumoniae.
2C – Representação microbiológica das colônias de Klebsiella pneumoniae (bacilos Gram negativos).
Fonte: o autor.
Neste meio de cultura seletivo, os microrganismos identificados foram: Escherichia coli, Klebsiella pneumoniae produtora de betalactamase de espectro estendido (ESBL+), Klebsiella pneumoniae sensível, Klebsiella oxytoca, Serratia marscences, Citrobacter freundii, Enterobacter sakazakii e Enterobacter aerogenes. Seis pacientes (20%) tiveram crescimento destes microrganismos, sendo que cada uma das bactérias não se repetiam entre as amostras.
No Ágar Mannitol Salt obtiveram-se as maiores porcentagens de crescimento de microrganismos, porém sem diferenças estatisticamente significantes. Na Figura 4, observa-se que nos tempos 0h e 96h o crescimento dos microrganismos foi o mesmo para os dois setores hospitalares (93,3% e 100%, respectivamente), enquanto que em 48h houve 92,3% na UTI e 100% na Clínica Médica (Teste Exato de Fisher, p = 1,000). Apesar dos diferentes tempos de coleta das amostras, não houve diferença entre elas (Teste G tabelas de contingência L x C, p = 0,6804 - UTI e p = 0,6947 – Clínica Médica).
Figura 4 – Crescimento de colônias de microrganismos no Ágar Mannitol Salt

4A – Presença de crescimento de colônias microbianas no meio de cultura Ágar Mannitol Salt, em amostras obtidas de mucosa do dorso de língua de pacientes internados na UTI e na Clínica Médica, nos diferentes tempos de internamento (0h-48h-96h).
4B – Placa de Petri com crescimento de colônias de Staphylococcus aureus.
4C – Representação microbiológica das colônias de Staphylococcus aureus (cocos Gram positivos).
Fonte: o autor.
Dentre as colônias visualizadas no meio Ágar Mannitol Salt, foram identificadas as seguintes espécies: Staphylococcus aureus (26,6% - 8 pacientes), Staphylococcus epidermides (70% - 21 pacientes), Staphylococcus saprophyticus (23,3% - 7 pacientes) e Kocuria spp. (3,3% - 1 paciente). Comparando os diferentes tempos de internamento, a UTI se sobressaiu em função do seu aumento progressivo no número de pacientes com presença de S. aureus, presente em 20% de pacientes no primeiro dia de internamento, 23,1% deles em 48 horas e 50% em 96 horas após o internamento. A partir do antibiograma realizado para as amostras de S. aureus,do total de oito pacientes com o microrganismo, três deles (37,5%) eram MRSA.
De acordo com a Tabela 2, dos 10 pacientes que fizeram uso de tubo orotraqueal, 30% (n=3) apresentaram pneumonia durante as primeiras 96 horas de internamento no setor. Durante o internamento na UTI, dois pacientes apresentaram PAV. O primeiro (P1) com 74 anos de idade, tendo como microrganismo desencadeador o Acinetobacter baumanii multirresistente; e o segundo paciente (P2), de 67 anos de idade, com PAV desencadeada por MRSA. Na Clínica Médica obteve-se um caso de Pneumonia Clínica (paciente (P3) com 82 anos de idade), o qual esteve internado e intubado anteriormente na UTI da mesma Instituição. A KPC foi o microrganismo de início.
Tabela 2 – Perfil da microbiota bucal dos pacientes que apresentaram
pneumonia durante as primeiras 96 horas de internamento no setor.
PACIENTE |
GÊNERO |
IDADE |
SETOR |
MEIOS DE CULTURA |
MICRORGANISMO DESENCADEADOR DA PNEUMONIA |
|||
CETRIMIDE |
MANNITOL SALT |
BILE ESCULINA |
MAC CONKEY |
|||||
P1 |
Feminino |
74 |
UTI |
- |
Staphylococcus saprophyticus
Staphylococcus epidermides MR |
- |
- |
Acinetobacter baumanii |
P2 |
Masculino |
67 |
UTI |
- |
Staphylococcus aureus MRSA |
- |
- |
Staphylococcus aureus MRSA |
P3 |
Masculino |
82 |
Clínica Médica |
- |
Staphylococcus epidermides MR |
Enterococcus sp. |
Klebsiella pneumoniae ESBL+ |
Klebsiella pneumoniae KPC |
Fonte: o autor.
Dentre os microrganismos identificados nos meios de cultura, encontraram-se no P1 o Staphylococcus epidermides multirresistente e o Staphylococcus saprophyticus (Ágar Mannitol Salt) no primeiro e terceiro dia de internamento. O P2 obteve como microrganismo presente o Staphylococcus aureus multirresistente (Ágar Mannitol Salt), a partir do 3° dia de internamento. Diferente dos pacientes anteriores, o P3 apresentou crescimento de microrganismos em três meios de cultura: Klebsiella pneumoniae ESBL positivo (Ágar Mac Conkey), Staphylococcus epidermides multirresistente (Ágar Mannitol Salt) e Enterococcus sp. (Ágar Bile Esculina com Azida), todos desde o 1° dia de internamento (Tabela 2).
O presente estudo demonstrou similaridade em suas amostras nos dois setores de internamento. A média de idade entre os tempos de coleta da amostra se mantiveram similares tanto na UTI (variação de 73,3 a 73,5 anos), quanto na Clínica Médica (variação entre 70,7 a 73,6 anos). Em relação ao gênero dos pacientes, os grupos também permaneceram semelhantes.
Todos os meios de cultura da pesquisa tiveram pelo menos uma amostra com crescimento bacteriano, confirmando que mesmo bactérias que não são comuns na cavidade bucal, podem estar presentes durante o internamento hospitalar (Fidel et al, 2013; Amaral et al, 2009). Pacientes internados, principalmente em UTI, estão mais susceptíveis a essas alterações na microbiota bucal em função do estresse, do sistema imune debilitado e da hipossalivação. Os pacientes que apresentam secreções salivares mucoespessadas podem, em conjunto com antimicrobianos, adquirir a multirresistência de microrganismos no biofilme bucal já alterado (Pineda et al, 2006).
No meio de cultura Ágar Mannitol Salt, o microrganismo mais identificado foi o Staphylococcus epidermidis, que geralmente é encontrado em mucosas e tecido epitelial de pacientes não hospitalizados (Otto, 2009). Na cavidade bucal, exerce importante função na patogênese da doença periodontal, estando presente no biofilme dentário, principalmente em pacientes com diabetes mellitus (Sánchez-Cordero et al, 1979). De acordo com Dahlém e Wikstrüm (1995), de 535 pacientes avaliados com periodontite refratária, 54,4% deles apresentaram S. epidermidis no biofilme dentário (o qual foi o microrganismo mais detectado), concluindo que a ocorrência de microrganismos em grande quantidade, não comuns na cavidade bucal, favorecem a manutenção das infecções bucais.
Os Staphylococcus aureus são bactérias Gram-positivas normalmente presentes nas fossas nasais, na orofaringe, no sistema gastrintestinal e na pele (Evangelista e Oliveira, 2015). Em pacientes imunossuprimidos, favorecem a ocorrência de infecções respiratórias, de pele e de tecidos moles (Skov e Jensen, 2009). Podem estar presentes no biofilme dentário de pacientes com doença periodontal (Pace e Andrade, 2007). Loberto e Jorge (2002) avaliaram 88 pacientes com periodontite crônica, verificando a presença de S. aureus em bolsas periodontais de quatro pacientes (4,5%) e na cavidade bucal de 22 pacientes (25%). Dados similares foram obtidos neste estudo.
A resistência do S. aureus à oxacilina (antimicrobiano análogo à meticilina) foi a responsável pela origem do termo “MRSA” (Methicillin-resistant Staphylococcus aureus) (Bassetti et al, 2009). O mesmo estudo de Loberto e Jorge (2002), avaliou também a resistência das 22 amostras de S. aureus da cavidade bucal de pacientes com periodontite crônica e concluiu que todas apresentaram multirresistência – MRSA; diferente dos resultados obtidos no estudo, no qual somente 37,5% do S. aureus foram multirresistentes.
O gênero das Pseudomonas spp. é o mais amplo grupo de bactérias Gram negativas existente (Gomila et al, 2015). Normalmente não causa doenças em indivíduos saudáveis, mas afeta pacientes hospitalizados que apresentam doenças crônicas (Pace e Andrade, 2007). Em boca estará presente no biofilme dentário de pacientes com doença periodontal (Sánchez-Cordero et al, 1979). A baixa porcentagem de Pseudomonas spp. identificadas na presente pesquisa pode não corresponder aos achados da literatura em função do sítio de coleta na cavidade bucal ser diferente (dorso de língua), enquanto que nos estudos de Sánchez-Cordero et al. (1979) e Pace e Andrade (2007) incluíram avaliações do biofilme dentário.
Os Enterococcus spp. são bactérias Gram positivas e comumente encontradas no sistema gastrintestinal (Walter e Ley, 2011). Na cavidade bucal, geralmente estão relacionados com infecções endodônticas e periodontais persistentes (Paradella et al, 2007). Rôças e Siqueira (2011) avaliaram o biofilme de 47 elementos dentários com canais obturados e encontraram a presença de E. faecalis em 64% dos dentes.
A Klebsiella pneumoniae é um bacilo Gram negativo que pode estar na água, no solo, em vegetais e em fezes. Quando produtora de Carbapenemase é considerada uma bactéria restrita aos hospitais. Os microrganismos Citrobacter freundii, Enterobacter sakazakii, Enterobacter aerogenes, e Klebsiella pneumoniae foram identificados na presente pesquisa em 20% (6 pacientes) dos pacientes da UTI e Clínica Médica. Gaetti-Jardim Júnior et al (2014) verificaram a presença destas mesmas bactérias em amostras de material biológico da mucosa de 8 pacientes (16%) com quadros infecciosos graves que estavam internados em uma UTI em Araçatuba-SP, de um total de 50 pacientes avaliados, demonstrando semelhança entre os achados.
Oliveira et al. (2007) avaliaram 30 pacientes com amostras de aspirado traqueal e de biofilme no dorso da língua e na superfície dos primeiros molares superiores, sendo que 70% das bactérias identificadas foram encontradas somente no biofilme bucal. Entre os microrganismos estão a Pseudomonas aeruginosa, o Staphylococcus aureus, Staphylococcus sp. e a Klebsiella pneumoniae, demonstrando semelhanças com a presente pesquisa.
Os microrganismos que desencadearam Pneumonia foram diferentes nos três participantes da pesquisa. No primeiro paciente (P1), a presença do Acinetobacter baumanni não foi verificada na cavidade bucal, em função deste microrganismo não ter sido elencado junto do NCIH para a pesquisa. O MRSA, responsável pela PAV no P2, é relatado na literatura como um dos principais microrganismos multirresistentes identificados em IRAS (Skov e Jensen, 2009). Neste paciente, pode-se identificar a presença do MRSA também na cavidade bucal, demonstrando a relação direta da PAV na Odontologia. Em relação ao P3, a KPC, identificada na Pneumonia Clínica, também foi verificada na coleta do material biológico do primeiro dia de internamento (antes mesmo do resultado da cultura traqueal para a pneumonia), evidenciando a importância do controle do biofilme bucal pela realização da higiene bucal durante o internamento hospitalar como forma de prevenção de pneumonias.
A partir dos dados da pesquisa, verificou-se que houve crescimento de colônias de microrganismos nos diferentes meios de cultura testados (Ágar Bile Esculina com Azida, Ágar Cetrimide, Ágar MacConkey e Ágar Mannitol Salt), porém não houve diferença estatística significante em relação aos tempos de internamento (0h x 48h x 96h) e aos setores hospitalares (UTI x Clínica Médica), exceto para o meio Ágar Bile Esculina com Azida. Identificaram-se todos os microrganismos elencados na pesquisa (Staphylococcus spp., Pseudomonas spp., Klebsiella spp., e Enterococcus spp.) em amostras biológicas de dorso de língua, estando presentes também o Staphylococcus spp. e a Klebsiella spp. com padrões de multirresistência, o que demonstra a importância da higiene bucal durante o internamento hospitalar, para controle da microbiota bucal e para prevenção de Pneumonia Associada à Ventilação Mecânica e Pneumonia Clínica.
Agradecemos às acadêmicas Isabela Vargenski, Paola Ogrodoviski e Fernanda Pereira da Silva do curso de Odontologia da UEPG, bem como às acadêmicas Letícia Lopes Menezes Almeida e Larissa Guidolin do curso de Farmácia da UEPG pelo comprometimento, trabalho e apoio no Laboratório de Microbiologia-UEPG.
Aguiar MCA, Oliveira ERA. Eficácia de medidas de higiene bucal sobre a microbiotal oral potencialmente patogênica para pneumonia aspirativa em idosos residentes em instituições de longa permanência [tese]. Natal: Universidade Federal do Rio Grande do Norte; 2008.
Amaral SM, Cortês AQ, Pires FR. Nosocomial pneumonia: importance of the oral environment. J. Bras. Pneumol.2009; 35(11):1116-24.
ANVISA – Agência Nacional de Vigilância Sanitária. Legislação e Criação de um Programa de Prevenção e Controle de Infecção Hospitalar (Infecção Relacionada à Assistência à Saúde – IRAS). Módulo 1, p.1-52, 2004.
ANVISA – Agência Nacional de Vigilância Sanitária. Medidas de Prevenção de Infecção Relacionada à Assistência à Saúde. Série: Segurança do Paciente e Qualidade em Serviços de Saúde, p.1-92, 2013.
Bassetti M, Nicco E, Mikulska M. Why is community associated MRSA spreading across the world and how will it change clinical practice? Int J Antimicrob Agents. 2009; 34 (Suppl 1):S15-9.
Dahlén G, Wikstrüm M. Ocorrence of enteric rods, staphylococci and Candida in subgingival samples. Oral Microbiol Immunol. 1995; 10(1):42-6.
Desvarieux M, Demmer RT, Jacobs DR Jr, et al. Periodontal bacteria and hypertension: the oral infections and vascular disease epidemiology study (INVEST). J Hypertens. 2010; 28(1):1413–1421.
Diaz MMO, Silveira CAN. Pneumonia Associada à Ventilação Mecânica em pacientes adultos internados nas Unidades de Terapia Intensiva de hospital público e privado, janeiro de 2006 a junho de 2010 [tese]. Brasília: Universidade de Brasília; 2011.
EUCAST - European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Version 4.0, [atualizado em 2014, citou em outubro 2015]. Disponível a partir de: http://www.eucast.org.
Evangelista SS, Oliveira AC. Staphylococcus aureus meticilino resistente adquirido na comunidade: um problema mundial. Rev. Bras. Enferm. 2015; 68(1):136-43.
Fidel Junior RAS, Lourenço RA, Fischer RG. A doença periodontal e o idoso frágil. Revista do Hospital Universitário Pedro Ernesto. 2013; 12(1):1-14.
Gaetti-Jardim Júnior E, Okamoto AC, Meca LB, Silva PP, Bombarda F et al. Família Entreobacteriaceae, Acinetobacter baumanii e Pseudomonados na microbiota bucal de pacientes mantidos em unidades de terapia intensiva. Arch. Health Invest. 2014; 3(4):40-8.
Galhardo TSC, Terezan MLF, Terezan AF, Fischer RG. Associação de periodontite crônica severa generalizada em pacientes com diabetes melito tipo 2 e dislipidemia grave. Relato de caso. Braz. J. Periodontol. 2015; 25(1):46-51.
Glurich I, Acharya A, Shukla SK, Nycz GR, Brilliant MH. The Oral-Systemic Personalized Medicine Model at Marshfield Clinic. Oral Dis. 2014; 19(1):1-17.
Gomila M, Peña A, Mulet MM, Lalucat J, García-Valdés E. Phylogenomics and systematics in Pseudomonas. Front. Microbiol. 2015; 6(1):214.
Guimarães MMQ, Rocco JR. Prevalência e prognóstico dos pacientes com pneumonia associada à ventilação mecânica em um hospital universitário. J. Bras. Pneumol. 2006; 32(4):339-346.
Hasan NA, Young BA, Minard-Smith AT, Saeed K, Li H, Heizer EM et. al. Microbial community profiling of human saliva using shotgun metagenomic sequencing. PLoS One, 9, e97699, 2014.
Kshirsagar AV, Moss KL, Elter JR, Beck JD, Offenbacher S, Falk RJ. Periodontal disease is associated with renal insufficiency in the Atherosclerosis Risk In Communities (ARIC) study. Am J Kidney Dis. 2005; 45:650–657.
Loberto JCS, Jorge AOC. Staphylococcus spp. na cavidade bucal e na bolsa periodontal de indivíduos com periodontite crônica: presença e sensibilidade aos antibióticos [tese]. São José dos Campos: Universidade Estadual Paulista; 2002.
Oliveira LCBS et al. A presença de patógenos respiratórios no biofilme bucal de pacientes com pneumonia nosocomial. Rev Bras Ter Intensiva. 2007; 19(4):428-33.
Otto M. Staphylococcus epidermidis - the “acidental” pathogen. Nat Rev. 2009; 7(1):555-67.
Pace MA, Andrade D. Avaliação clínica e microbiológica da cavidade bucal de pacientes críticos com entubação orotraqueal de um hospital de emergência [tese]. Ribeirão Preto: Universidade de São Paulo; 2007.
Paradella TC, Koga-Ito CY, Jorge AOC. Enterococcus faecalis: considerações clínicas e microbiológicas. Rev Odontol UNESP. 2007; 36(2):163-8.
Pineda LA, Saliba RG, Solh AA. Effect of oral descontamination with chlorhexidine on the incidence of nosocomial pneumonia: a meta-analysis. Crit. Care, 2006; 10(1):206-10.
Rôças IN, Siqueira JE. Comparison of the in vivo antimicrobial effectiveness of sodium hypochlorite and chlorhexidine used as root canal irrigants: a molecular microbiology study. J. Endod. 2011; 37(2):143-50.
Sánchez-Cordero S, Hoffman H, Stahl SS. Occurrence of Staphylococcus in periodontal pockets of diabetic and nondiabetic adults. J Periodontol. 1979; 50(3):109-13.
Skov RL, Jensen KS. Community-associated meticillin resistant Staphylococcus aureus as a cause of hospital acquired infections. J Hosp Infect. 2009; 73(4):364-70.
Walter J, Ley R. The human gut microbiome: Ecology and recent evolutionary changes. Annu Rev Microbiol. 2011; 65(1):411-29.
Washio J, Shimada Y, Yamada M, Sakamaki R, Takahashi N. Effects of pH and lactate on hydrogen sulfide production by oral Veillonella spp. Appl Environ Microbiol. 2014; 80(1):4184-8.
Zarco MF, Vess TJ, Ginsburg GS. The oral microbiome in health and disease and the potential impacto on personalized dental medicine. Oral Dis. 2012; 18(1):109-20.
1. (Programa de Mestrado Interdisciplinar em Ciências da Saúde, Universidade Estadual de Ponta Grossa – UEPG, Ponta Grossa, Brasil) . Email: camithomazs@hotmail.com
2. (Programa de Residência Multiprofissional em Saúde do Idoso, Hospital Universitário Regional dos Campos Gerais – HURCG, Ponta Grossa, Brasil). Email: fernandacmileo_31@hotmail.com
3. (Departamento de Odontologia - DEODON, Universidade Estadual de Ponta Grossa – UEPG, Ponta Grossa, Brasil). Email: ebcampagnoli@yahoo.com.br
4. (Departamento de Odontologia – DEODON, Universidade Estadual de Ponta Grossa - UEPG, Ponta Grossa, Brasil). Email: shelonsouzap@gmail.com
5. (Departamento de Ciências Farmacêuticas, Universidade Estadual de Ponta Grossa – UEPG, Ponta Grossa, Brasil). Email: esmerino@uepg.br
6. (Programa de Doutorado em Odontologia, Universidade Estadual de Ponta Grossa – UEPG, Ponta Grossa, Brasil). Email: evelynlleite@gmail.com