

Vol. 38 (Nº 02) Año 2017. Pág. 4
Idelfonso Leandro BEZERRA 1; Reginaldo Gomes NOBRE 2; Marcelo Tavares GURGEL 3; Hans Raj GHEYI 4; Pedro Dantas FERNANDES 5
Recibido: 28/07/16 • Aprobado: 23/08/2016
RESUMO: Neste trabalho, pretendeu-se avaliar os efeitos da salinidade da água de irrigação, no desenvolvimento inicial de dois clones de cajueiro anão precoce. O trabalho foi realizado no Campo Experimental da Embrapa, Pacajus, CE. O delineamento experimental foi o de blocos casualizado, com quatro repetições. Aos 25 e 40 dias após a semeadura avaliou-se: área foliar, relação raíz/parte aérea, razão de área foliar, taxas de crescimento absoluto, de crescimento relativo e de assimilação líquida. O aumento da salinidade induziu uma redução significativa no crescimento vegetativo, um aumento significativo na relação raiz/parte aérea e decréscimo na taxa de crescimento absoluto dos clones. |
ABSTRACT: In this work, we sought to evaluate the effects of irrigation water salinity in the initial development of two clones of dwarf cashew. The work was performed in the Experimental Field of Embrapa, Pacajus, CE. The experimental design was a randomized block design with four replications. At 25 and 40 days after sowing were evaluated: leaf area, ratio root/shoot, leaf area ratio, absolute growth rate, relative growth and net assimilation. Increased salinity induced a significant reduction in vegetative growth, a significant increase in the root/shoot ratio and decrease in the absolute growth rate of the clones. |
O cajueiro (Anacardium occidentale L.) é uma planta dicotiledônea pertencente à família Anacardiaceae, é uma espécie tropical nativa do Brasil, dispersa em quase todo território. A plantação de caju vem apresentando crescimento significativo nos últimos anos. O setor revelou-se forte em patrocinar renda para os agricultores e flexível na abertura de novas vagas de emprego. O Brasil destaca-se como um dos principais produtores de castanha de caju. O Ceará está no topo do ranking, com uma área plantada de 407.455 ha e uma produtividade média de 407 kg ha-1 de castanha de caju (IBGE, 2013) em condições de sequeiro, porém apresentando grande potencial de aumento sob condições irrigadas.
De resultados de pesquisas destaca-se a criação de novas variedades como é o caso mais notável das cultivares de cajueiro anão precoce, com índices de produtividade muito maiores que as tradicionais variedades. Esse novo material apresenta caráter precoce produzindo no início do segundo ou terceiro ano de plantação e atinge a estabilidade em torno do quinto ano, com produção média de 905 e 1.493 kg ha-1 para os clones CCP06 e CCP1001, respectivamente, podendo ser cultivadas quer em áreas irrigadas quer de sequeiro. Outras pesquisas aperfeiçoaram a técnica de preparação de substratos e acondicionamento das mudas permitindo a obtenção de plantas mais vigorosas devido à nutrição ser mais eficiente com menos custos de produção, uma vez que é evidente a economia de espaço, água e de substratos (Embrapa, 2003).
Estudos recentes têm demonstrado a ocorrência de variabilidade genética em cajueiro anão precoce, em relação aos limites de tolerância à salinidade de solo e água (Ferreira-Silva et al., 2010). Essa diversidade está associada à capacidade de exclusão de íons (Na+ e/ou Cl-), tanto em plântulas (Ferreira-Silva et al., 2008) como em mudas enxertadas (Ferreira-Silva et al., 2009, 2010).
Assim, o presente trabalho teve como objetivo estudar os efeitos de diferentes concentrações de sais na água de irrigação no desenvolvimento inicial de dois clones de cajueiro anão precoce (CCP06 e CCP1001).
O trabalho de campo foi conduzido na área experimental da Empresa Brasileira de Pesquisa Agropecuária (Embrapa), Pacajus, CE, situada nas coordenadas geográficas de 4º 10’ de latitude S e 38º 27’ de longitude W e altitude média de 60 m.
Foram estudados os efeitos de 6 níveis de salinidade da água de irrigação (condutividade elétrica – CEa 0,5; 1,5; 2,5; 3,5; 4,5 e 5,5 dS m-1 caracterizados de S1 a S6, respectivamente) sobre o crescimento de dois porta-enxertos de cajueiro (clone C1- CCP06 e C2 - CCP1001). As águas de irrigação foram preparadas a partir de soluções 1N de NaCl, de CaCl2.2H2O e de MgCl2.6H2O, utilizando-se água de poço da área experimental (CEa = 0,5 dS m-1), mantendo-se a proporção equivalente de 7:2:1 entre Na:Ca:Mg, respectivamente, semelhante em águas encontradas na região Nordeste (Medeiros, 1992). O delineamento experimental adotado foi o de blocos casualizados, com 4 repetições, sendo a parcela constituída por 54 plantas. O substrato utilizado foi o padrão usado pela Embrapa/Agroindústria Tropical, composto de uma mistura na proporção de 1:2:1 de terra superficial arenosa (Neossolo), casca de arroz carbonizada e palha de carnaúba (Copernicia prunifera) triturada. Previamente à instalação do ensaio, realizaram-se análises do substrato, cujas características químicas, determinadas de acordo com metodologias recomendadas pela Embrapa (2006), constam no Tabela 1.

Para cultivo das mudas foram utilizados tubetes plásticos (6,3 cm de diâmetro e 18,7 cm de altura), com capacidade para 288 mL e abertura na parte inferior para permitir livre drenagem. Os tubetes foram dispostos em bandejas com capacidade para 54 unidades, as quais ficavam apoiadas em bancadas metálicas (cantoneiras), a uma altura de 0,80 m do solo. Após o enchimento dos tubetes o substrato foi submetido a 12 lavagens utilizando-se 2 L de água do poço em cada aplicação, de forma a reduzir a salinidade do substrato. As sementes foram devidamente selecionadas e usou-se uma semente por tubete, inserindo-a na posição vertical, com a base voltada para cima (ponto de inserção da castanha ao pedúnculo), à profundidade de aproximadamente 3 cm, conforme recomendação da Embrapa (2003).
As irrigações foram manuais e efetuadas diariamente ao final da tarde. No cálculo do volume aplicado foi prevista uma fração de lixiviação de 40%, de forma a não haver acumulação de sais no substrato. Os demais tratos culturais, como controle de ervas daninhas, adubação e tratamentos fitossanitários, seguiram os procedimentos empregados na área experimental da Embrapa.
Aos 25 e 40 dias após a semeadura (DAS) foram colhidas 16 plantas por tratamento (4 por repetição), onde se avaliou área foliar (AF) e a relação raiz/parte aérea (R/PA = FR/FPA, em g g-1) de acordo com Magalhães (1979). Houve avaliação, ainda, de razão de área foliar (RAF = AF/FST, em cm2 g-1), da taxa de crescimento absoluto (TCA = (P2 – P1)/(t2 – t1), em mg dia-1), taxa de crescimento relativo (TCR = TCA/FST, em mg mg-1 dia-1) e taxa de assimilação líquida (TAL = TCA/RAF, em mg cm-2 dia-1) a partir dos modelos propostos por Cairo (1995) e Benincasa (2003). Vale salientar que FR e FPA são fitomassa seca da raiz e da parte aérea (g); AF é área foliar (cm2) e FST é a fitomassa seca total (g); P1 e P2 – peso da matéria seca total (g), respectivamente, no tempo t1 e no tempo t2 (dia).
A área foliar das plantas foi determinada com auxilio de um medidor eletrônico (modelo “LI – 3000A”). A fitomassa seca foi obtida numa estufa de ventilação forçada a 65 ºC até peso constante. Os dados obtidos foram avaliados mediante análise de variância pelo teste ‘F’ e nos casos de significância, foi realiada análise de regressão polinomial, de acordo com Ferreira (2003).
A salinidade da água de irrigação afetou significativamente (p<0,01) a área foliar (AF), relação raiz/parte aérea (R/PA) e razão de área foliar (RAF), aos 25 DAS, enquanto que aos 40 DAS, os efeitos foram significativos (p<0,01) para AF, (p<0,05) para R/PA e RAF (Tabela 2). Com base nos modelos matemáticos obtidos, a área foliar foi afetada linear e negativamente pela salinidade, nas duas épocas de avaliação, com decrementos relativos de 4,92 e 4,18%, respectivamente, por aumento unitário de CEa (Figura 1A). Segundo Tester & Davenport (2003) este decréscimo da área foliar, possivelmente, está relacionado com a adaptação das plantas à salinidade, diminuindo a superfície transpirante em condições de estresse salino em virtude de reduzida disponibilidade de água pela diminuição de potencial hídrico no substrato.
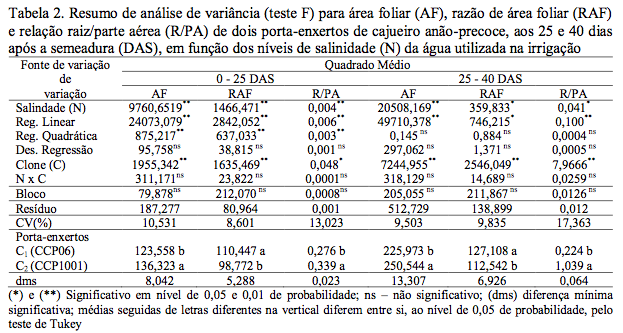

Figura 1. Área foliar – AF (A), razão de área foliar – RAF (B) e relação raiz/parte aérea – R/PA (C),
em função da salinidade da água de irrigação aos 25 e 40 dias após a semeadura (DAS)
de dois porta-enxertos de cajueiro anão precoce.
Verificou-se ainda que os “clones” responderam diferentemente aos tratamentos, ou seja, o genótipo CCP1001 apresentou, em média, 9,36 e 9,80% mais área foliar do que o CCP06 aos 25 e 40 DAS, respectivamente (Tabela 2). Meireles (1999) também ao trabalhar com os mesmos clones constatou maior crescimento de CCP1001, em relação CCP06, aos 30 e 60 DAS.
Na razão de área foliar (RAF) (Figura 1B) constatou-se que a salinidade afetou negativamente nas duas épocas de avaliação (25 e 40 DAS), sendo lineares as equações obtidas em cada época. Os decréscimos relativos da RAF, foram de 2,57 e 1,26%, por incremento de CEa, respectivamente. Essas diminuições foram consequências do efeito negativo da salinidade tanto na AF como em fitomassa da parte área. Vale salientar que, os efeitos deletérios da salinidade foram menores com o tempo devido, provavelmente a adaptação das plantas no meio salino.
Houve diferença significativa entre os clones, sobre a razão de área foliar, aos 25 e 40 DAS, em nível de 0,01 de probabilidade (Tabela 2). Em ambos os períodos, os valores referentes ao CCP06 foram superiores aos do CCP1001, com redução de 10,57 e 11,46%.
Quanto à relação raiz/parte aérea (R/PA) (Figura 1C); verificou-se aumento linear significativo (p<0,01), de 1,80 aos 25 DAS e 3,64%, (p<0,05) aos 40 DAS, por incremento unitário de CEa.
Aos 25 DAS, a R/PA cresceu lentamente (Figura 1C), com efeito linear, tal fato ocorreu devido à fitomassa seca da raiz ter decrescido da mesma forma, bem como, em função da pequena taxa de redução ocorrida em termos de fitomassa seca da parte aérea. Já aos 40 DAS, a R/PA cresceu rapidamente com o incremento dos níveis de salinidade, sendo maior a taxa de redução de fitomassa seca da parte aérea. Esses dados estão de acordo com observações de Azevedo Neto & Tobosa (2000) podendo ser um indicativo de adaptação morfológica da cultura à salinidade.
Os clones apresentaram valores estatisticamente diferentes da relação – R/PA (Tabela 2). A relação R/PA em CCP1001, aos 25 DAS (0,3397 g g-1) e aos 40 DAS (1,0391 g g-1), foi significativamente superior (p<0,05) ao registrado em CCP06 (0,2761 e 0,2243 g g-1), respectivamente.
A taxa de crescimento absoluto (TCA) das plantas foi afetada significativamente (p<0,01) pela salinidade da água de irrigação, nas duas datas de avaliação (Tabela 3).
A TCA decresceu linearmente com aumento da salinidade (Figura 2). Os decréscimos relativos da TCA, por aumento unitário de CEa, foram de 2,25 e 2,30% aos 25 e 40 DAS, respectivamente; verificou-se ter aumentado o percentual de decréscimo da TCA, ao longo do ciclo, denotando o aumento da sensibilidade à salinidade com o passar do tempo. Torres et al. (2014), estudando o desenvolvimento de mudas de cajueiro anão precoce sob água salina, verificaram, também, decréscimo linear sobre a TCA das plantas com o incremento da CEa.
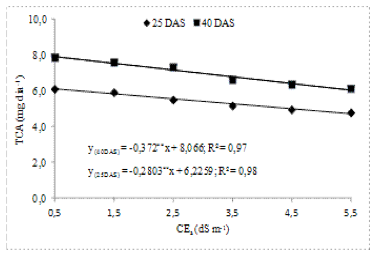
Figura 2. Taxa de crescimento absoluto (TCA), em função da salinidade da água de irrigação aos 25 e 40 dias após a semeadura (DAS) de dois porta-enxertos de cajueiro anão precoce.
Houve diferença significativa (p<0,05) entre clones (Tabela 3). Em ambos os períodos de avaliação, os valores referentes ao CCP1001 foram significativamente superiores aos de CCP06, com os decréscimos relativos de 6,89 e 5,75%, aos 25 e 40 DAS, respectivamente. Também Carneiro (2001), ao avaliar a TCA aos 50 e 100 DAS em cajueiro anão precoce, constatou decréscimo por incremento unitário de CEa de 8,59 e 15,53%, respectivamente.
Quanto à taxa de crescimento relativo (TCR) e à taxa de assimilação líquida (TAL), verificou-se que a salinidade da água de irrigação (CEa) não exerceu efeito significativo aos 25 a 40 DAS. Ainda, segundo a Tabela 3, nota-se que na TAL o fator clone foi significativo (p<0,05). Observando as médias para clone verifica-se que os valores de TAL do clone CCP1001, aos 25 e 40 DAS, foram em média 1,51 e 1,44% maiores do que os de CCP06.
Silva (2002), testando níveis de salinidade da água de irrigação semelhantes aos do presente trabalho, em porta-enxertos de mangueira, não verificou efeito significativo da CEa sobre TCA, TCR e TAL em avaliações realizadas aos 30, 40 e 60 dias após a semeadura.
O porta-enxerto CCP1001 desenvolveu uma maior área foliar, relação raiz/parte e taxa de crescimento absoluto.
Em ambos os períodos, a razão de área foliar dos enxertos decresceu drasticamente com o aumento da salinidade da água de irrigação.
Os dois índices taxa de crescimento relativo e taxa de assimilação líquida não foram influenciados com o incremento da condutividade elétrica da água de irrigação.
A interação salinidade da água x clone não foi significativa.
AZEVEDO NETO, A.D. de e TABOSA, J.N. (2000). Estresse salino em plântulas de milho. Parte I: análise do crescimento. Revista Brasileira de Engenharia Agrícola e Ambiental, Campina Grande, vol.4, n. 2, p.159-164.
BENINCASA, M.M.P. (2003). Análise de crescimento de plantas. Jaboticabal: FUNEP, 42p.
CAIRO, P.A.R. (1995). Curso básico de relações hídricas de plantas. Vitória da Conquista: UESB. 32 p.
CARNEIRO, P.T. (2001). Germinação e desenvolvimento inicial de clones de cajueiro anão-precoce sob condições de salinidade. Dissertação de Mestrado. Universidade Federal de Campina Grande, Brasil. 85 p.
EMBRAPA (2003). Empresa Brasileira de Pesquisa Agropecuária. Aspectos agronômicos sobre a cultura do cajueiro. Centro Nacional de Pesquisa de Agroindústria Tropical. Fortaleza, 43 p.
EMBRAPA (2006). Empresa Brasileira de Pesquisa Agropecuária. Centro Nacional de Pesquisa do Solo. Sistema Brasileiro de Classificação de Solos. 2 ed. Rio de Janeiro, Embrapa Solos. 306 p.
FERREIRA, P.V. (2003). Estatística experimental aplicada à agronomia. Maceió: UFAL; EDUFAL; FUNDEPES. 422 p.
FERREIRA‑SILVA, S.L.; SILVA, E.N.; CARVALHO, F.E.L.; LIMA, C.S.; ALVES, F.A.L.; SILVEIRA, J.A.G. da. (2010). Physiological alterations modulated by rootstock and scion combination in cashew under salinity. Scientia Horticulturae. vol.127, p.39‑45.
FERREIRA‑SILVA, S.L.; SILVEIRA, J.A.G. da; VOIGT, E.L.; SOARES, L.S.P.; VIÉGAS, R.A. (2008) Changes in physiological indicators associated with salt tolerance in two contrasting cashew rootstocks. Brazilian Journal of Plant Physiology. v.20, p.51‑59.
FERREIRA‑SILVA, S.L.; VOIGT, E.L.; VIÉGAS, R.A.; PAIVA, J.R. de; SILVEIRA, J.A.G. da. (2009) Influência de porta‑enxertos na resistência de mudas de cajueiro ao estresse salino. Pesquisa Agropecuária Brasileira, v.44, p.361‑367.
INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA. Sistema IBGE de recuperação automática. Disponível em: Acesso em: 05 mar., 2013.
MAGALHÃES, A.C.N. (1979) Análise quantitativa de crescimento. In: Ferri, M.G. 2. ed. Fisiologia vegetal. São Paulo: EPU; EDUSP. p. 331-350.
MEDEIROS, J.F. de. (1992) Qualidade da água de irrigação e evolução da salinidade nas propriedades assistidas pelo “GAT” nos Estados do RN, PB e CE. Dissertação de Mestrado. Universidade Federal da Paraíba. Brasil. 173 p.
MEIRELES, A.C.M. (1999). Salinidade da água de irrigação e desenvolvimento de mudas de cajueiro anão precoce (Anacardium occidentale L.). Dissertação de Mestrado. Universidade Federal do Ceará. Brasil. 60 p.
SILVA, J.M. da. (2002). Germinação e desenvolvimento inicial de porta-enxertos de mangueira sob condições de salinidade. Dissertação de Mestrado. Universidade Federal de Campina Grande. Brasil. 85 p.
TESTER, M.; DAVENPORT, R. (2003). Na+ tolerance and Na+ transport in higher plants. Annals of Botany, v.91, p.503-527.
TORRES, E. C. M.; FREIRE, J. L. O.; OLIVEIRA, J. L.; BANDEIRA, L. B.; MELO, D. A.; SILVA, A. L. (2014). Biometria de mudas de cajueiro anão irrigadas com águas salinas e uso de atenuadores do estresse salino. Nativa, Sinop, v.2, n.2, p.71-78.
1. Engenheiro Agrônomo – Doutorando em Engenharia Agrícola, área de concentração (Irrigação e Drenagem) Universidade Federal de Campina Grande/UFCG – CEP 58.429-900 – Campina Grande,PB, Brasil, e-mail: idelfosobezerra@gmail.com
2. Engenheiro Agrônomo – Professor Doutor – Unidade Acadêmica de Ciências Agrárias – Universidade Federal de Campina Grande/UFCG – CEP 58.840-000 – Pombal, PB, Brasil, e-mail: rgomesnobre@pq.cnpq.br
3. Engenheiro Agrônomo – Professor Doutor – Departamento de Ciências Ambientais e Tecnológicas –Universidade Federal Rural do Semi-Árido/UFERSA – CEP 59.625-900 – Mossoró, RN, Brasil, email: marcelo.tavares@ufersa.edu.br
4. Engenheiro Agrônomo – Professor Doutor – Núcleo de Engenharia de Água e Solo/NEAS – Universidade Federal do Recôncavo da Bahia/UFRB – CEP 44.380-000 – Cruz das Almas, BA, Brasil, e-mail: hans@pq.cnpq.br
5. Engenheiro Agrônomo – Professor Doutor – Pró-Reitoria de Pós-Graduação e Pesquisa/UEPB – CEP 58.429-500 – Campina Grande, PB, Brasil, email: pdantas@pq.cnpq.br